O objetivo deste trabalho foi entender o padrão de
distribuição de B. tabaci na cultura da soja (Morris 1960, Southwood 1978).
Autores: Daniela Moro¹,²; Dener R. Ferreira¹; Lauren B. Castilhos¹; Henrique Pozebon¹,²; Guilherme Padilha¹; Sarah E. Forgiarini¹; Jonas A. Arnemann¹.
 Introdução
Introdução
As moscas-brancas do gênero Bemisia (Hemiptera: Aleyrodidae) compreendem um complexo de espécies cosmopolitas de pragas (Byrne & Bellows Jr., 1991), com amplo espectro de hospedeiros vegetais (Basu, 1995) e alto potencial de danos em regiões tropicais e subtropicais devido aos danos diretos e indiretos que causam em várias culturas (Vieira et al, 2012). Danos decorrentes da ingestão de seiva da planta (direto), transmissão de viroses e porta de entrada para fungos (indiretos).
O desenvolvimento de planos de amostragem onde se consiga determinar o tamanho das unidades amostrais, o número de amostras a serem feitas e a alocação das amostras na planta, dependem de uma compreensão da distribuição espacial do inseto na cultura-alvo. Portanto, o objetivo deste trabalho foi entender o padrão de distribuição de B. tabaci na cultura da soja (Morris 1960, Southwood 1978).
Material e Métodos
Foram coletados 225 folíolos de 25 plantas de soja selecionadas aleatoriamente (cultivar BMX Tornado RR), na fase de crescimento R5 (Fehr & Caviness, 1977), em uma lavoura comercial localizada no município de Santa Cruz do Sul, Rio Grande do Sul, Brasil. Foram amostrados os terços superior, médio e inferior das plantas, coletando-se aleatoriamente uma folha trifoliolada por terço.
Os folíolos esquerdo, central e direito de cada trifólio foram separados, acondicionados em sacos de papel separados, identificados, armazenados em um refrigerador com gelo e transportados para o Molecular Insect Lab (UFSM), onde foram mantidos sob refrigeração (8 °C) até a contagem de ninfas de mosca-branca. Os folíolos coletados (esquerdo, central e direito) foram divididos em 32 seções de 1,0 cm2 cada, dispostos em uma matriz de oito fileiras e quatro colunas divididas pela veia central. Em cada seção dos folíolos foram contabilizadas separadamente as ninfas dos ínstares N1, N2, N3 e N4.
Em seguida, foi calculado o número total de ninfas (N1+N2+N3+N4). A contagem de ninfas de mosca-branca foi realizada com auxílio de um microscópio digital com aumento de 13x, modelo Zeiss Discovery V12. Para compreender o padrão de distribuição de B. tabaci nos folíolos das 25 plantas de soja em condições de campo, foram calculados a média (m) e variância (s²) para cada uma das 32 seções de 1 cm² avaliadas nos folíolos, utilizando-se o número total de ninfas de mosca branca (N1+N2+N3+N4) como variável.
Resultados e Discussão
As densidades populacionais de mosca-branca em plantas de soja variaram de acordo com os terços da planta avaliada, e a distribuição de ninfas nos folíolos apresenta um padrão de concentração em áreas especificas da superfície foliar. A densidade populacional de ninfas de mosca-branca não difere entre os folíolos esquerdo, central e direito da folha de soja. Há uma maior concentração de todos os ínstares ninfais de B. tabaci no terço médio das plantas de soja, seguido dos terços inferior e superior (Figura 1).
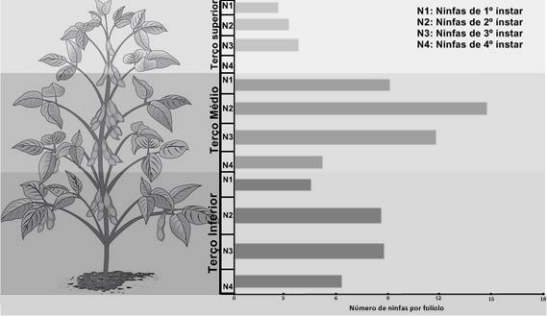 Figura 1. Distribuição de ninfas de B. tabaci em plantas de soja.
Figura 1. Distribuição de ninfas de B. tabaci em plantas de soja.
Conclusão
As ninfas de 2º e 3º ínstar predominam sobre as de 1º e 4º ínstar. A maior concentração de todos os ínstares ninfais de B. tabaci ocorre no terço médio da planta de soja, seguido dos terços inferior e superior, respectivamente.
Confira nossa galeria de cursos TOTALMENTE ONLINE! Agregue conhecimento, faça já!
Referências
Byrne DN & Bellows Junior TS (1991) Whitefly biology. Annual Review of Entomology 36: 431-457.
Basu AN (1995) Bemisia tabaci (Gennadius): crop pest and principal whitefly vector of plant viruses. Oxford & IBH, New Delhi, India.
Czepak C, Coelho ASG, Rezende JM, Nunes MLS, Weber ID, Silvério RF & Albernaz-Godinho KC (2018) Bemisia tabaci MEAM1 population surveys in soybean cultivation. Entomologia Experimentalis et Applicata 166: 215–223.
Fehr WR & Caviness CE (1977) Stages of soybean development. Special Report 87. Avalilable at: http://lib.dr.iastate.edu/specialreports/87
Morris, R. F. 1960. Sampling insect populations. Annu. Rev. Entomo!. 5: 243-64.
Southwood, T.R.E. 1978. Ecological methods, 2nd ed., Chapman & Hall, London.
Vieira SS, Boff MIC, Bueno AF, Gobby AL, Lobo RV & Bueno RCOF (2012) Efeitos dos inseticidas utilizados no controle de Bemisia tabaci (Gennadius) biótipo B e sua seletividade aos inimigos naturais na cultura da soja. Ciências Agrárias 33: 1809-1818.
Informações dos autores
¹Grupo de Pesquisa Molecular Insect Lab da UFSM;
²Bolsista Capes.
Disponível em: Anais do II Congresso Online para Aumento de Produtividade do Milho e Soja (COMSOJA), Santa Maria, 2019.



