A cultura da soja é atacada por várias pragas que podem prejudicar sua produtividade, entre elas a mosca-branca – Bemisia tabaci biótipo B – a qual tem levado preocupação a profissionais e produtores, devido aos danos causados e à dificuldade de controle. A intensiva atividade agrícola, com sucessões de culturas e ampla janela de semeadura na região do Cerrado, além da seleção de populações resistentes a inseticidas, a não rotação de cultivos e o desequilibro no sistema de produção favorecem o aumento populacional de B. tabaci em soja, e em outros cultivos importantes como feijão e algodão. Segundo Lourenção e Nagai (1994), o biótipo B se caracteriza, em comparação ao biótipo A, por possuir maior número de plantas hospedeiras, maior resistência a inseticidas e capacidade de induzir desordens fisiológicas em certos tipos de hospedeiros.
Bemisia tabaci é um inseto sugador que, durante a alimentação, pode introduzir na seiva doenças viróticas, as quais provocam desenvolvimento desuniforme na planta e queda na produtividade, como a necrose da haste da soja, e o mosaico dourado do feijoeiro (Almeida, 2008). Além disso, ao se alimentar, excreta parte da seiva rica em açúcares sobre as folhas, favorecendo o crescimento de fungos oportunistas (como os do gênero Capnodium), gerando um aspecto escurecido, mais conhecido como fumagina. Isto leva à redução da área foliar e da taxa fotossintética e, por consequência, da produtividade.
O ciclo biológico do inseto é constituído pela fase de ovo, quatro ínstares ninfais, sendo o último instar denominado de “pseudopupa” e, finalmente, os adultos (macho e fêmea). O primeiro ínstar se locomove durante alguns minutos após emergir do ovo, até encontrar o local mais adequado na planta para se fixar. Os adultos medem cerca de 1,0 mm de comprimento (fêmea maior que o macho), possuindo o dorso amarelo-pálido e dois pares de asas membranosas de cor branca. A fecundidade média é de 100 a 300 ovos/fêmea, podendo variar em função da planta hospedeira e de fatores ambientais. Os ovos possuem coloração amarela clara, medindo cerca de 0,2 mm de comprimento, e são colocados na face inferior das folhas (Bueno et al., 2013).
Os primeiros surtos de B. tabaci na soja foram detectados em 1996, no norte do Paraná e sul de São Paulo, provocando perdas entre 30 e 80% (Lourenção et al., 1999). O nível de controle para esta praga na soja ainda não foi determinado, no entanto faz parte de estudos de diversas instituições no Brasil (Hirose et al., 2010, Yamada et al., 2017).
O controle de B. tabaci é realizado, quase que exclusivamente, pelo uso de inseticidas químicos e devido às características biológicas do inseto, há a preocupação sobre possíveis problemas de resistência aos inseticidas (Dângelo et al., 2018). A principal estratégia de manejo da resistência é a alternância de produtos com mecanismos de ação distintos, associado ao uso racional destes produtos, com o objetivo de reduzir a pressão de seleção de indivíduos resistentes (Sosa-Gomez; Omoto, 2012, Tecnologias…, 2013). Além disso, o monitoramento de populações do inseto em diferentes regiões produtoras do Brasil é importante para o manejo de resistência e na orientação sobre os produtos mais adequados (Dângelo et al., 2018).
O uso inadequado dos inseticidas traz riscos à saúde humana e contribui para a contaminação ambiental. A suspeita de efeitos danosos sobre abelhas e outros insetos benéficos tem motivado a restrição de uso de determinados inseticidas na cultura da soja (IBAMA, 2012; Rocha, 2012), principalmente aqueles destinados ao manejo de insetos sugadores, como os percevejos e a mosca-branca.
Neste contexto, é importante conhecer a eficiência relativa de controle da mosca-branca pelos inseticidas que já apresentam liberação de uso na cultura da soja, bem como por aqueles em fase de registro, para melhor orientar produtores e técnicos no manejo dessa importante praga. Assim, o objetivo desta publicação é apresentar os resultados dos experimentos cooperativos de inseticidas para a o controle de B. tabaci – biótipo B em soja, realizados nas safras 2017/2018 e 2018/2019.
Material e Métodos
Foram instalados 25 experimentos nas safras 2017/18 e 2018/19 por 13 instituições (Tabela 1). A lista de tratamentos (Tabelas 2 e 3), o delineamento experimental e as avaliações foram definidos por protocolo único, permitindo a sumarização conjunta dos experimentos. Os fungicidas utilizados nos tratamentos 3 a 5 apresentam registro no Ministério da Agricultura Pecuária e Abastecimento (MAPA), para o controle da mancha-alvo em soja, e os fungicidas dos tratamentos 1, 6 a 10 apresentam Registro Especial Temporário III (RET III).
Tabela 1. Instituições, locais de condução e número do ensaio nas safras 2017/2018 e 2018/2019.
 Tabela 2. Ingrediente ativo (i.a.), produto comercial (p.c.) e respectivas doses dos inseticidas utilizados em duas aplicações com intervalo de sete dias, para o controle de Bemisia tabaci – biótipo B em soja. Safra 2017/2018.
Tabela 2. Ingrediente ativo (i.a.), produto comercial (p.c.) e respectivas doses dos inseticidas utilizados em duas aplicações com intervalo de sete dias, para o controle de Bemisia tabaci – biótipo B em soja. Safra 2017/2018.
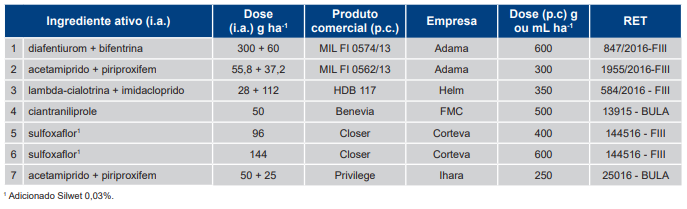 Tabela 3. Ingrediente ativo (i.a.), produto comercial (p.c.) e respectivas doses dos inseticidas utilizados em duas aplicações com intervalo de sete dias, exceto o tratamento 10, para o controle de Bemisia tabaci – biótipo B em soja. Safra 2018/2019.
Tabela 3. Ingrediente ativo (i.a.), produto comercial (p.c.) e respectivas doses dos inseticidas utilizados em duas aplicações com intervalo de sete dias, exceto o tratamento 10, para o controle de Bemisia tabaci – biótipo B em soja. Safra 2018/2019.
 O delineamento experimental em todos os ensaios foi o de blocos causalizados. Para a aplicação dos produtos foi utilizado pulverizador costal pressurizado com CO2 e volume de aplicação mínimo de 120 L ha-1. Em todos os tratamentos foram realizadas duas aplicações com um intervalo de sete dias, com exceção do tratamento 10 [dinotefuram + piriproxifem, 100 + 25 g (i.a.) ha−1] na safra 2018/2019, onde foi testada uma única aplicação. As avaliações foram realizadas aos 7 dias após a primeira aplicação, e aos 3, 7, 10 e 15 dias após a segunda aplicação, coletando-se 10 folhas no terço médio das plantas na área central da parcela.
O delineamento experimental em todos os ensaios foi o de blocos causalizados. Para a aplicação dos produtos foi utilizado pulverizador costal pressurizado com CO2 e volume de aplicação mínimo de 120 L ha-1. Em todos os tratamentos foram realizadas duas aplicações com um intervalo de sete dias, com exceção do tratamento 10 [dinotefuram + piriproxifem, 100 + 25 g (i.a.) ha−1] na safra 2018/2019, onde foi testada uma única aplicação. As avaliações foram realizadas aos 7 dias após a primeira aplicação, e aos 3, 7, 10 e 15 dias após a segunda aplicação, coletando-se 10 folhas no terço médio das plantas na área central da parcela.
As folhas foram levadas ao laboratório para a contagem de ninfas (1°, 2° e 3° ínstares e “pseudopupas”), com auxílio de microscópio estereoscópio, com lentes de aumento de 20x ou superior. Em cada avaliação, a eficiência (Ef%) foi expressa como uma relação entre a quantidade de insetos encontrada na amostra de cada tratamento e da testemunha. Para estimar a produtividade, foram colhidos 5,0 m das duas linhas centrais de cada parcela, corrigindo a umidade para 13%. A determinação da produtividade de grãos foi estabelecida pela fórmula:
Produtividade (kg ha-1) = [0,001* (100-US)* PP] / [(100- 13)* AC]
Onde:
- US = umidade da semente (%);
- PP = peso por parcela (kg);
- AC = área colhida da parcela (m²).
Nas análises isoladas foram observados: o quadrado médio residual, o coeficiente de variação, o coeficiente de assimetria, o coeficiente de curtose e a normalidade da distribuição de resíduos (Shapiro; Wilk, 1965). As análises conjuntas de eficiência e de produtividade foram realizadas utilizando-se técnicas de modelos lineares generalizados mistos, os quais permitem a adoção de distribuições não-normais e a acomodação dos efeitos das interações entre locais e tratamentos por meio de alterações na estrutura da matriz de covariâncias. Para identificar todos os tratamentos com prováveis efeitos semelhantes, foi utilizado o teste de comparações múltiplas de Tukey (p≤0,05). Todos os modelos investigados foram obtidos usando-se o procedimento glimmix, em rotinas implementadas no sistema SAS/STAT® software, versão 9.4 (SAS/STAT, c2016).
Resultados e Discussão
Na safra 2017/2018, em função das diferenças de infestação na pré-contagem (0 dda1) verificada entre os ensaios (quadrados médios) dividiu-se a análise em dois grupos. O primeiro grupo (ensaios 1, 2, 3 e 8) reuniu os ensaios com população média de 6,5 a 7,7 ninfas por folíolo de soja (menor infestação) e o outro grupo (ensaios 6, 7, 9, e 10) com populações que se apresentavam de 24,1 a 32,2 ninfas por folíolo (maior infestação).
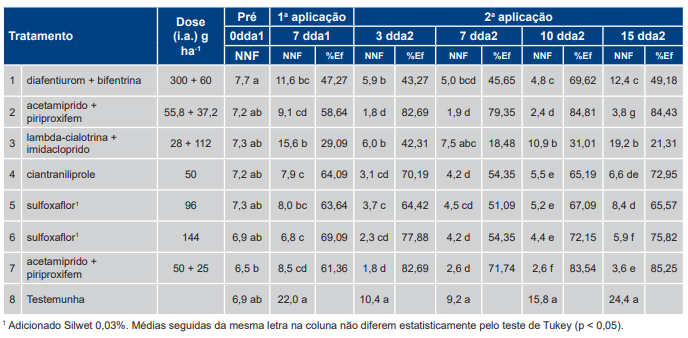
Na análise do grupo de menor infestação (Tabela 4), após a primeira avaliação (7 dda1), todos os tratamentos apresentaram diferenças significativas em relação à testemunha, com exceção do T3 [lamba-cialotrina + imidaclopride – 28 + 112 g (i.a.) ha−1], aos 7 dias após a 2ª aplicação (7 dda2). Aos 15 dda2 a eficiência (Ef%) variou de 21,3% a 85,2%. As maiores eficiências de controle em 15 dda2 foram observadas nos tratamentos T2 e T7, ambos com a mistura acetamiprido + piriproxifem, nas doses (55,8 + 37,2) e (50 + 25) g (i.a.) ha−1, respectivamente. Independente do tratamento utilizado não houve 100% de controle em nenhuma das avaliações realizadas.
Tabela 4. Número de ninfas por folíolo (NNF) e eficiência (Ef%) dos tratamentos com inseticidas específicos para Bemisia tabaci – biótipo B em relação à testemunha sem controle aos 7 dias após a primeira aplicação (dda1) e aos 3, 7, 10 e 15 dias após a segunda aplicação (dda2) dos ensaios que apresentaram população média de 6,5 a 7,7 ninfas por folíolo na avaliação prévia (menor infestação) na safra 2017/2018.
Na Tabela 5, é apresentada a análise do agrupamento de maior infestação para a safra 2017/2018. Nas avaliações de 3, 7 e 10 dda2 todos os tratamentos diferiram significativamente da testemunha. Nesse agrupamento, novamente, as maiores eficiências de controle na última avaliação (15 dda2) foram observadas nos tratamentos T2 e T7, ambos com a mistura acetamiprido + piriproxifem, nas doses (55,8 + 37,2) e (50 + 25) g (i.a.) ha-1, respectivamente. Independente do tratamento utilizado não houve eliminação da população da praga.
Tabela 5. Número de ninfas por folíolo (NNF) e eficiência (Ef%) dos tratamentos com inseticidas específicos para Bemisia tabaci – biótipo B em relação à testemunha sem controle aos 7 dias após a primeira aplicação (dda1) e aos 3, 7, 10 e 15 dias após a segunda aplicação (dda2) dos ensaios que apresentaram população média 24,1 a 32,2 ninfas por folíolo na prévia (maior infestação) na safra 2017/2018.
 Na safra 2018/2019, em função das diferenças de infestação inicial, identificado nas análises dos quadrados médios dividiu-se os ensaios em dois grupos. Sendo o primeiro grupo, caracterizado pela menor infestação inicial composta pelos ensaios 1, 3, 6, 8 e 14 com população média de 7,8 a 9,3 ninfas por folíolo de soja e o segundo grupo (ensaios 2, 4, 5, 9, 10, 11, 12 e 13) foi agrupado com população média de 9,5 a 11,8 ninfas por folíolo, denominada como maior infestação. De modo geral as infestações na testemunha foram maiores na ordem de 3 a 3,2 vezes (Tabelas 6 e 7).
Na safra 2018/2019, em função das diferenças de infestação inicial, identificado nas análises dos quadrados médios dividiu-se os ensaios em dois grupos. Sendo o primeiro grupo, caracterizado pela menor infestação inicial composta pelos ensaios 1, 3, 6, 8 e 14 com população média de 7,8 a 9,3 ninfas por folíolo de soja e o segundo grupo (ensaios 2, 4, 5, 9, 10, 11, 12 e 13) foi agrupado com população média de 9,5 a 11,8 ninfas por folíolo, denominada como maior infestação. De modo geral as infestações na testemunha foram maiores na ordem de 3 a 3,2 vezes (Tabelas 6 e 7).
Tabela 6. Número de ninfas por folíolo (NNF) e eficiência (Ef%) dos tratamentos com inseticidas específicos para Bemisia tabaci – biótipo B em relação à testemunha sem controle aos 7 dias após a primeira aplicação (dda1) e aos 3, 7, 10 e 15 dias após a segunda aplicação (dda2) dos ensaios que apresentaram população média 7,8 a 9,3 ninfas por folíolo (menor infestação) na safra 2018/2019.
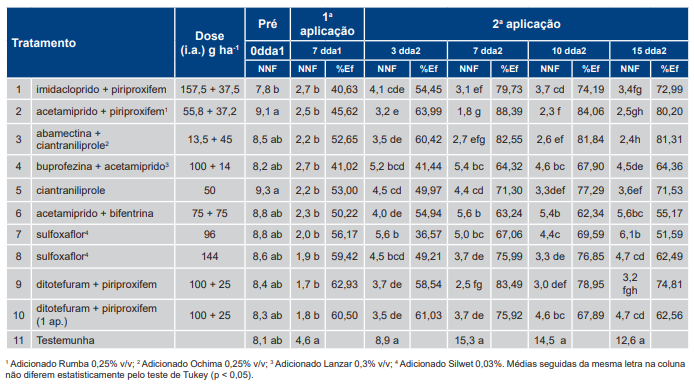 Tabela 7. Número de ninfas por folíolo (NNF) e eficiência (Ef%) dos tratamentos com inseticidas específicos para Bemisia tabaci – biótipo B em relação à testemunha sem controle aos 7 dias após a primeira aplicação (dda1) e aos 3, 7, 10 e 15 dias após a segunda aplicação (dda2) dos ensaios que apresentaram população média 9,5 a 11,8 ninfas por folíolo (maior infestação) na safra 2018/2019.
Tabela 7. Número de ninfas por folíolo (NNF) e eficiência (Ef%) dos tratamentos com inseticidas específicos para Bemisia tabaci – biótipo B em relação à testemunha sem controle aos 7 dias após a primeira aplicação (dda1) e aos 3, 7, 10 e 15 dias após a segunda aplicação (dda2) dos ensaios que apresentaram população média 9,5 a 11,8 ninfas por folíolo (maior infestação) na safra 2018/2019.
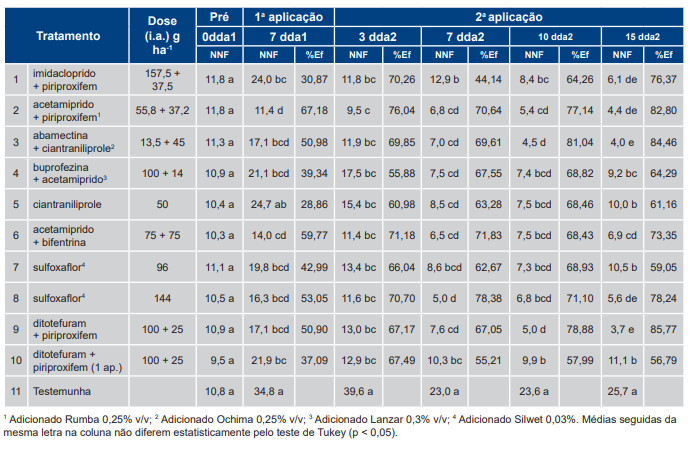 No agrupamento de menor infestação (Tabela 6), todos os tratamentos com inseticidas diferiram da testemunha (T11) a partir da primeira avaliação (7 dda1). Na última avaliação (15 dda2), os tratamentos: T9 [dinotefuram + piriproxifem, 100 + 25 g (i.a.) ha−1], T2 [acetamiprido + piriproxifem, 55,8 + 37,2 g (i.a.) ha−1] e T3 [abamectina + ciantraniliprole, 13,5 + 45 g (i.a.) ha−1] apresentaram as maiores eficiências de controle, respectivamente 74,8%, 80,2% e 81,3%.
No agrupamento de menor infestação (Tabela 6), todos os tratamentos com inseticidas diferiram da testemunha (T11) a partir da primeira avaliação (7 dda1). Na última avaliação (15 dda2), os tratamentos: T9 [dinotefuram + piriproxifem, 100 + 25 g (i.a.) ha−1], T2 [acetamiprido + piriproxifem, 55,8 + 37,2 g (i.a.) ha−1] e T3 [abamectina + ciantraniliprole, 13,5 + 45 g (i.a.) ha−1] apresentaram as maiores eficiências de controle, respectivamente 74,8%, 80,2% e 81,3%.
Na primeira avaliação (7 dda1), no agrupamento de maior infestação observou-se eficiência de controle entre os tratamentos na ordem de 28,9% [T5, ciantraniliprole, 50 g (i.a.) ha−1] a 67,2% [T2, acetamiprido + piriproxifem, 55,8 + 37,2 g (i.a.) ha−1], e não houve diferença estatísticas entre os tratamentos T1, T3, T4, T7, T8 e T10. Na última avaliação (15 dda2), as maiores eficiências de controle foram observadas nos tratamentos com imidacloprido + piriproxifem, 157,5 + 37,5 g (i.a.) ha−1 (T1, 76,4%), sulfoxaflor, 144 g (i.a.) ha−1 (T8, 78,2%), acetamiprido + piriproxifem, 55,8 + 37,2 g (i.a.) ha−1 (T2, 82,8%), abamectina + ciantraniliprole, 13,5 + 45 g (i.a.) ha−1 (T3, 84,5%) e dinotefuram + piriproxifem, 100 + 25 g (i.a) ha−1 (T9, 85,8%).
Independentemente do inseticida utilizado, não houve eliminação da população da praga. As menores populações aos 15 dias após a 2ª aplicação (15 dda2) foram 2,4 (agrupamento de menor infestação) e 3,7 ninfas por folíolo (agrupamento de maior infestação).
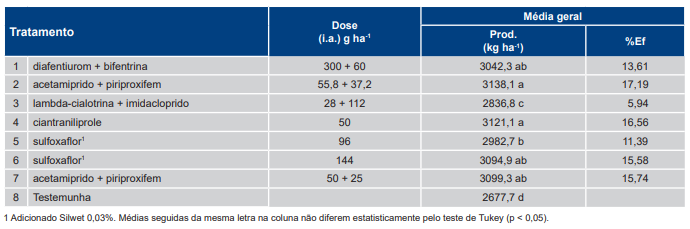
Na Tabela 8 são apresentadas as produtividades médias dos tratamentos na safra 2017/2018. A análise conjunta dos ensaios não apresentou diferenças na produtividade que justificassem a separação em dois grupos (menor e maior infestação). Os tratamentos T2 [acetamiprido + piriproxifem, 55,8 + 37,2 g (i.a.) ha−1], T4 [ciantraniliprole, 50 g (i.a.) ha−1], T7 [acetamiprido + piriproxifem, 50 + 25 g (i.a.) ha−1] e T6 [sulfoxaflor, 144 g (i.a.) ha−1], e T1 [diafentiurom + bifentrina, 300 + 60 g (i.a.) ha−1] apresentaram as maiores médias de produtividade diferindo significativamente da testemunha. Vale destacar que a diferença média do tratamento com a maior produtividade (T2) em relação à testemunha (T9) foi de 460,4 kg ha-1, e a produtividade na testemunha foi significativamente menor em comparação a todos os tratamentos com inseticidas.
Tabela 8. Produtividade média (kg ha−1) e eficiência (%Ef) dos tratamentos com inseticidas específicos para Bemisia tabaci – biótipo B em relação à testemunha sem controle (T8) nos ensaios da safra 2017/2018.
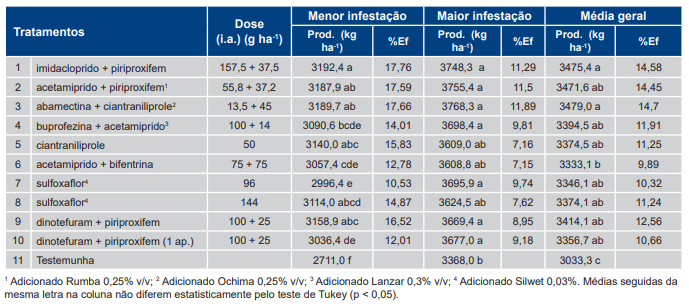
Na safra 2018/2019, a análise das médias de produtividade entre os ensaios permitiu separá-las em dois grupos: menor e maior infestação. No agrupamento de menor infestação a produtividade foi mais contrastante (Tabela 9). Os tratamentos: T1 [imidacloprido + piriproxifem, 157,5 + 37,5 g (i.a.) ha−1], T3 [abamectina + ciantraniliprole, 13,5 + 45 g (i.a.) ha−1], T2 [acetamiprido + piriproxifem, 55,8 + 37,2 g (i.a.) ha−1], T9 [dinotefuram + piriproxifem, 100 + 25 g (i.a.) ha−1], T5 [ciantraniliprole, 50 g (i.a.) ha−1] e T8 [sulfoxaflor, 144 g (i.a.) ha−1] foram os que apresentaram maiores produtividades. Destaca-se que a diferença média do ratamento com a maior produtividade (T1) em relação à testemunha (T11) foi de 481,5 kg ha−1. No grupo de maior infestação, as diferenças entre as produtividades dos tratamentos com inseticidas foram menores, havendo diferenças significativas apenas entre os tratamentos com inseticidas e a testemunha (T11).
Nos ensaios realizados em ambas as safras, não foi observada fitotoxicidade nas plantas de soja em nenhum dos tratamentos.
Tabela 9. Produtividade média (kg ha−1) e eficiência (%Ef) dos tratamentos com inseticidas específicos para Bemisia tabaci – biótipo B em relação à testemunha sem controle (T11) nos ensaios da safra 2018/2019.
Conclusão
Os tratamentos com inseticidas reduziram significativamente a população de ninfas de Bemisia tabaci biótipo B nas condições dos ensaios realizados nas safras 2017/2018 e 2018/2019.
Os níveis populacionais de ninfas de Bemisia tabaci biótipo B nas testemunhas (sem controle) nas análises conjuntas nas safras 2017/2018 e 2018/2019 reduziram a produtividade significativamente quando comparada com as produtividades obtidas nos tratamentos com inseticidas.
Autores:
- Germison Vital Tomquelski – engenheiro-agrônomo, doutor, Fundação Chapadão, Chapadão do Sul, MS;
- Edson Hirose – engenheiroagrônomo, doutor, Embrapa Soja, Londrina, PR; Alex Farias, engenheiro-agrônomo;
- Alex Faria – Agro Pesquisa, Porto Nacional, TO;
- Cecilia Czepak – engenheira-agrônoma, doutora, UFG, Goiânia, GO;
- Fabio Kempim Pittelkow – engenheiro-agrônomo, doutor, Fundação Rio Verde, Lucas de Rio Verde, MT;
- Elderson Ruthes – engenheiro-agrônomo, mestre, Fundação ABC, Castro, PR;
- José Fernando Jurca Grigolli – engenheiro-agrônomo, doutor, Fundação MS, Maracaju, MS;
- Jurema Rattes – engenheira-agrônoma, doutora, Rattes Consultoria, Rio Verde, GO;
- Lucia Madalena Vivan, engenheira-agrônoma, doutora, Fundação MT, Rondonópolis, MT;
- Marcio Marcos Goussain Junior – engenheiroagrônomo, doutor, Assist Consultoria, Confresa, MT;
- Marcio Fernandes Peixoto – engenheiro-agrônomo, doutor, MR Pesquisa, Uberlândia, MG;
- Marco Antonio Tamai – engenheiro-agrônomo, doutor, UNEB, Barreiras, BA;
- Milton Akio Ide – engenheiro-agrônomo, Ide Consultoria, Luís Eduardo Magalhães, BA;
- Mônica Cagnin Martins, engenheira-agrônoma, doutora, Círculo Verde Assessoria Agronômica, Luís Eduardo Magalhães, BA;
- Tatiane Lobak – engenheira-agrônoma, mestre, Instituto Phytus, Planaltina, DF.
Referências
ALMEIDA, A. M. R. Viroses da soja no Brasil: sintomas, etiologia e controle. Londrina: Embrapa Soja, 2008. 61 p. (Embrapa Soja. Documentos, 306).
BUENO, A. de F.; HOFFMANN-CAMPO, C. B.; SOSA-GOMEZ, D. R. Mosca-branca. In: LEITE, R. M. V. B. de C.; SARAIVA, O. F. (Ed.). Árvore do conhecimento soja. Brasília, DF: Embrapa, 2013. Disponível em: <https://www.agencia.cnptia.embrapa.br/gestor/soja/ arvore/CONT000fznzu9ib02wx5ok0cpoo6ariubmhq.html>. Acesso em: 10 dez. 2019
DÂNGELO, R. A. C.; MICHEREFF-FILHO, M.; CAMPOS, M. R.; SILVA, P. S.; GUEDES, R. N. Insecticide resistance and control failure likelihood of the whitefly Bemisia tabaci (MEAM1; B biotype): a Neotropical scenario. Annals of Applied Biology, v.172, n. 3, p. 88-99, 2018.
HIROSE, E.; BUENO, A. de F.; VIEIRA, S. S.; GOBBI, A. L. Danos causados por diferentes níveis de infestação de Bemisia tabaci Biótipo B (Hemiptera: aleyrodidae) em soja. In: REUNIÃO DE PESQUISA DE SOJA DA REGIÃO CENTRAL DO BRASIL, 31., 2010, Brasília, DF. Resumos… Londrina: Embrapa Soja, 2010. p. 84-86
IBAMA. Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis. Comunicado. Diário Oficial [da] República Federativa do Brasil, 19 jul. 2012. n.139, Seção 3, p.112.
LOURENÇÃO, A. L.; NAGAI. H. Surtos populacionais de Bemisia tabaci no Estado de São Paulo. Bragantia v. 53, n. 1, p. 53-59, 1994.
LOURENÇÃO, A. L.; YUKI, V. A.; ALVES, S. B. Epizootia de Aschersonia cf. goldiana em Bemisia tabaci (Homoptera: Aleyrodidae) Biótipo B no estado de São Paulo. Anais da Sociedade Entomológica do Brasil, v. 28, n. 2, p. 343-345, 1999.
ROCHA, M. C. L. S. A. Efeitos dos agrotóxicos sobre as abelhas silvestres no Brasil: proposta metodológica de acompanhamento. Brasília, DF: IBAMA, 2012. 88 p.
SAS/STAT®. Versão 9.4 do sistema SAS para Windows. Cary, NC: SAS Institute Inc., c2016.
SHAPIRO, S. S.; WILK, M. B. An analysis of variance test for normality (complete sample). Biometrika, v. 52, n. 3, p. 591-611, 1965.
SOSA-GÓMEZ, D. R.; OMOTO, C. Resistência a inseticidas e outros agentes de controle em artrópodes associados à cultura da soja. In: HOFFMANN-CAMPO, C. B.; CORRÊA-FERREIRA, B. S.; MOSCARDI, F. (Ed.). Soja: manejo integrado de insetos e outros artrópodes-praga. 1 ed. Brasília, DF: Embrapa, 2012. p. 673-723.
TECNOLOGIAS de produção de soja – Região Central do Brasil 2014. Londrina: Embrapa Soja, 2013. 265 p. (Embrapa Soja. Sistemas de Produção, 16).
YAMADA, M.; CAMARGO, G. R.; BARBOSA, Y.; TOMQUELSKI, G. V. Quebra de ciclo. Cultivar: grandes culturas, v. 215, p. 16-18, 2017.
Fonte: Embrapa