Com o objetivo de gerar informações sobre a eficiência de biofungicidas para subsidiar as recomendações de manejo do mofo-branco em soja, os experimentos cooperativos tiveram início na safra 2009/2010. Esta publicação apresenta os resultados sumarizados dos experimentos conduzidos na safra 2018/2019.
Autores: Maurício Conrado Meyer, Hercules Diniz Campos, Claudia Vieira Godoy, Carlos Mitinori Utiamada, Maria Cristina Neves de Oliveira, David de Souza Jaccoud Filho, Wilson Story Venancio, Flávio Henrique Vasconcelos de Medeiros, Fernando Cezar Juliatti, Luciana Celeste Carneiro, José Nunes Junior, Mônica Cagnin Martins.
Fonte: Embrapa, CIRCULAR TÉCNICA, 155, de novembro de 2019.
O fungo Sclerotinia sclerotiorum (Lib.) de Bary, causador do mofo-branco em inúmeras culturas de importância econômica no mundo, é responsável por reduções médias de rendimento na cultura da soja da ordem de 20% a 30%, podendo chegar a 70% em algumas lavouras. Estima-se que 28% da área de produção de soja brasileira esteja infestada pelo patógeno, totalizando mais de 10 milhões de hectares que necessitam da adoção de medidas integradas de manejo da doença (Meyer et al., 2019). Uma importante característica do patógeno é a produção de escleródios, estruturas resistentes às variações ambientais que permitem a sua sobrevivência no solo de uma safra para outra e constituem a principal fonte de inóculo da doença.
A germinação dos escleródios pode ocorrer de duas formas: miceliogênica – quando ocorre a formação de micélio através de microporos dos escleródios, ou carpogênica – quando há formação de apotécios (Görgen et al., 2010; Reis et al., 2019). A infecção das plantas de soja ocorre principalmente pelos ascósporos do fungo, que são produzidos nos apotécios, decorrentes da germinação carpogênica dos escleródios. Esses ascósporos colonizam preferencialmente as pétalas, que servem de substrato para o desenvolvimento do patógeno e o início da infecção nas hastes e nos pecíolos (Grau; Hartman, 2015). A manutenção da umidade do solo é fundamental para a ocorrência do mofo-branco, pois a germinação dos escleródios depende de alta umidade (chuvas frequentes), de temperaturas entre 15 °C e 25 °C, e de pouca incidência de luz solar (sombreamento do solo pelas plantas) (Jaccoud Filho et al., 2017; Reis et al., 2019).
Os escleródios podem ser parasitados por diversos microrganismos no solo, condição que sustenta a utilização do controle biológico como medida de controle da doença, por meio da aplicação de produtos formulados a base de antagonistas, principalmente compostos por espécies do fungo Trichoderma e da bactéria Bacillus (Görgen et al., 2010). Existem mais de 30 formulações comerciais de biofungicidas registradas no Ministério da Agricultura, Pecuária e Abastecimento (Mapa) e em uso nas lavouras de soja no Brasil (Agrofit, c2003). A aplicação de antagonistas deve ser realizada antes da germinação dos escleródios, ou seja, quando os escleródios se encontram em repouso no solo (Meyer et al., 2016a). Para a eficiência do controle biológico, condições de ambiente semelhantes às que favorecem a germinação carpogênica dos escleródios são necessárias para o estabelecimento dos agentes de biocontrole, cujas estruturas de reprodução são ainda mais sensíveis e dependentes dessas condições. Por essa razão, o sistema de semeadura direta sobre palha de gramíneas tem se mostrado um pré-requisito para o sucesso dessa medida de controle (Campos et al., 2010; Görgen et al., 2010; Reis et al., 2019).
Material e Métodos
Os experimentos da safra 2018/2019 foram realizados em 12 locais distribuídos nos estados do Paraná, de Goiás, da Bahia e de Minas Gerais (Tabela 1), com o objetivo de avaliar a eficiência de biofungicidas no controle do mofo-branco da soja. Os experimentos foram realizados em delineamento de blocos casualizados, com quatro repetições e parcelas de seis linhas de 6 m de comprimento (16,2 m2 a 18 m2), estabelecendo-se uma parcela útil de 4 linhas de 5 m.
As aplicações foram realizadas com pulverizador costal pressurizado com CO2 e volume de calda variando entre 150 L/ha e 200 L/ha. Foram realizadas duas aplicações dos agentes de biocontrole no início do estádio vegetativo, em V2 e V4, respectivamente. Os tratamentos foram compostos por duas formulações de propágulos de Trichoderma asperellum, uma de T. harzianum, uma de Bacillus subtilis e um tratamento testemunha, sem aplicação de biofungicidas (Tabela 2).
Tabela 1. Instituições, locais onde os experimentos foram instalados, cultivares utilizadas e datas de semeadura da soja, época de aplicação dos biofungicidas e de incubação dos escleródios para análise de viabilidade, safra 2018/2019.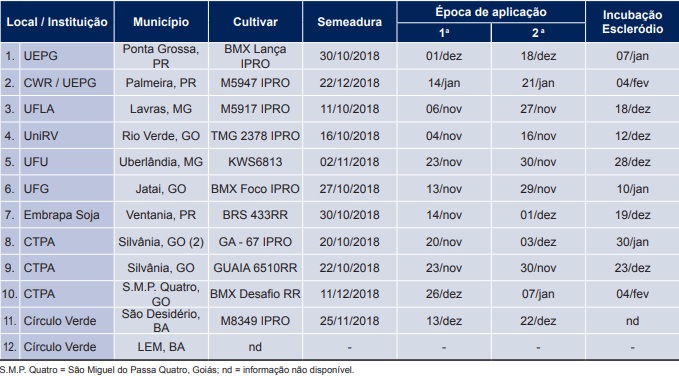 Fonte: Embrapa, Circular Técnica 155, Londrina, PR. Novembro 2019.
Fonte: Embrapa, Circular Técnica 155, Londrina, PR. Novembro 2019.
Tabela 2. Tratamentos com biofungicidas (p.c.= produto comercial), ingrediente ativo, empresa fabricante, épocas de aplicação e doses utilizadas no ensaio cooperativo de controle biológico de mofo-branco em soja, safra 2018/2019.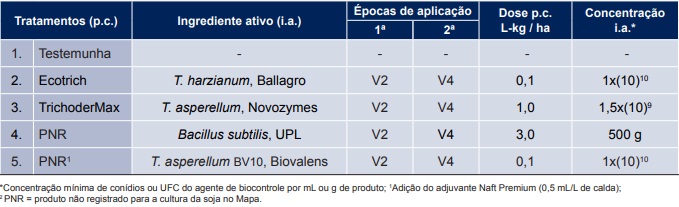 Fonte: Embrapa, Circular Técnica 155, Londrina, PR. Novembro 2019.
Fonte: Embrapa, Circular Técnica 155, Londrina, PR. Novembro 2019.
Amostras contendo 30 escleródios foram colocadas em sacos de tela de náilon com malha inferior a 1,0 mm e dispostas em bandejas de isopor (tipo marmita), com o fundo perfurado para garantir a drenagem da água de chuvas. As bandejas foram preenchidas com solo de barranco ou solo autoclavado, visando evitar contaminação com populações nativas de agentes antagônicos, não sendo utilizado solo de superfície da lavoura. As bandejas foram distribuídas no centro das parcelas e acomodadas de forma que metade de sua altura ficasse abaixo da superfície do solo. Cada bandeja recebeu um saquinho de tela contendo os escleródios, sendo levemente afundados no solo no centro da bandeja, de forma que sua face superior ficasse nivelada com a superfície do solo da bandeja.
Acomodada a amostra de escleródios, cada bandeja recebeu uma cobertura uniforme de palha picada, oriunda da gramínea utilizada como cobertura de solo da lavoura, utilizando-se apenas as partes aéreas da mesma, que não tenham tido contato com o solo. As bandejas foram regadas com água, após a cobertura com palha, para acomodação da mesma na superfície do solo e garantir umidade para os escleródios. Os tratamentos foram aplicados nas doses e épocas conforme o protocolo, em dias nublados ou chuvosos ou no final da tarde. Os resultados foram analisados individualmente para cada local, observando-se o quadrado médio residual, a assimetria e a curtose que foram avaliados pelos gráficos de boxplot, a normalidade da distribuição dos resíduos (Shapiro; Wilk, 1965). O teste de informação de Akaike (AIC) foi utilizado para a seleção do melhor modelo e neste caso foi aceito o modelo com efeitos aleatórios e a homogeneidade de variâncias dos tratamentos foi comparada pelo teste de Levene (1952).
A análise de resíduos foi avaliada no intervalo entre -2 e +2, dessa forma, valores que ultrapassassem esse intervalo foram considerados não representativos no conjunto de dados. Além das análises exploratórias individuais, a correlação entre a germinação carpogênica e a colonização por Trichoderma spp., o percentual de escleródios inviáveis e a razão de quadrados médios também foram utilizadas na seleção dos ensaios que compuseram as análises conjuntas. O teste de comparações múltiplas de médias de Tukey (p≤0,05) foi aplicado à análise conjunta, a fim de se obter grupos de tratamentos com efeitos semelhantes. Todas as análises foram realizadas utilizando o módulo GLIMMIX do programa SAS® versão 9.4 (SAS/STAT, 2016). As estimativas dos parâmetros foram realizadas pelo método de Máxima Verossimilhança Restrita (REML).
Resultados e Discussão
Dos 12 locais onde os ensaios foram conduzidos, seis locais foram utilizados na análise conjunta para o parâmetro germinação carpogênica (locais 1, 3, 4, 5, 6 e 7, Tabela 1), quatro locais para colonização de escleródios por Trichoderma spp. (locais 4, 5, 8 e 9, Tabela 1) e seis locais para escleródios inviáveis (locais 2, 4, 5, 6, 8 e 9, Tabela 1). Nenhum tratamento biofungicida inibiu significativamente a germinação carpogênica dos escleródios analisados, não apresentando diferença em relação ao tratamento testemunha – T1 (Tabela 3). Os tratamentos que apresentaram maiores percentuais de colonização de escleródios por Trichoderma spp. foram o T2 (T. harzianum, Ballagro) e o T5 (T. asperellum BV10, Biovalens), com valores de 26,6% e 21%, respectivamente (Tabela 3). Para escleródios inviáveis, os biofungicidas não diferiram entre si, mas apenas os tratamentos T2 (T. harzianum, Ballagro) e o T4 (Bacillus subtilis, UPL) superaram a testemunha sem aplicação T1, com percentuais de 16,2% e 15,1%, respectivamente (Tabela 3).
Tabela 3. Germinação carpogênica (G. Carpog.), percentual de controle de germinação carpogênica (C%), colonização de escleródios por Trichoderma spp. (Colon. Trich.) e escleródios inviáveis (Esc. Inv.) nos experimentos cooperativos de controle biológico de mofo-branco, safra 2018/2019.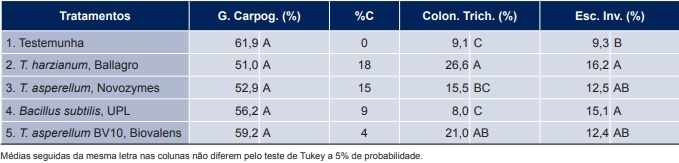 Fonte: Embrapa, Circular Técnica 155, Londrina, PR. Novembro 2019.
Fonte: Embrapa, Circular Técnica 155, Londrina, PR. Novembro 2019.
Os níveis de controle biológico de mofo-branco em soja observados nos experimentos da safra 2018/2019 não foram satisfatoriamente elevados, como os observados em safras anteriores (Meyer et al., 2016a; Meyer et al., 2016b), em função das condições ambientais desfavoráveis ao estabelecimento dos antagonistas no solo, principalmente relacionado à escassez de chuvas no período das aplicações dos tratamentos com os biofungicidas. A dependência de chuvas frequentes e de uniforme cobertura de solo com palhada de gramíneas certamente representa os principais entraves ao sucesso do controle biológico de mofo-branco em soja.
Otimize sua lavoura, conheça o curso de manejo de doenças em soja!
Referências
AGROFIT: consulta aberta. Brasília, DF: MAPA, c2003. Disponível em: <http://agrofit.agricultura.gov.br/agrofit_cons/principal_agrofit_ cons>. Acesso em: 31 jul. 2019.
CAMPOS, H. D.; SILVA, L. H. C. P.; MEYER, M. C.; SILVA, J. R. C.; NUNES JÚNIOR, J. Mofo branco na cultura da soja e os desafios da pesquisa no Brasil. Tropical Plant Pathology, Brasília, v. 35, p. C-CI, 2010.
GÖRGEN, C. A.; HIKISHIMA, M.; SILVEIRA NETO, A. N.; CARNEIRO, L. C.; LOBO JUNIOR, M. Mofo branco (Sclerotinia sclerotiorum). In: ALMEIDA. A. M. R.; SEIXAS, C. D. S. (Ed.). Soja: doenças radiculares e de hastes e inter-relações com o manejo do solo e da cultura. Londrina: Embrapa Soja, 2010. p. 73-104.
GRAU, C. R.; HARTMAN, G. L. Sclerotinia stem rot. In: HARTMAN, G. L.; RUPE, J. C.; SIKORA, E. J.; DOMIER, L. L.; DAVIS, J. A.; STEFFEY, K. L. Compendium of soybean diseases and 5th ed. St. Paul, MN: American Phytopathological Society, 2015. p. 59-62.
JACCOUD FILHO, D. S.; NASSER, L. C. B.; HENNENBERG, L.; GRABICOSKI, E. M. G.; JULIATTI, F. C. Mofo-branco: Introdução, histórico, situação atual e perspectivas. In: JACCOUD FILHO, D. S.; NASSER, L. C. B.; HENNENBERG, L.; GRABICOSKI, E. M. G. (eds.). Mofo branco. Ponta Grossa: Todapalavra, 2017. p. 29-73.
LEVENE H. On the power function of tests of randomness based on runs up and down. The Annals of Mathematical Statistics, v. 23, p. 34-56, 1952.
MEYER, M. C.; CAMPOS, H. D.; GODOY, C. V.; UTIAMADA, C. M. (Ed.). Ensaios cooperativos de controle biológico de mofobranco na cultura da soja – safras 2012 a 2015. Londrina: Embrapa Soja, 2016a. 46 p. (Embrapa Soja. Documentos, 368).
MEYER, M. C.; CAMPOS, H. D.; GODOY, C. V.; UTIAMADA, C. M.; SILVA, L. H. C. P. da; GOUSSAIN, M.; MARTINS, M. C.; NUNES JUNIOR, J.; VENANCIO, W. S.; PIMENTA, C. B.; BORGES, E. P.; JACCOUD FILHO, D. S.; CARNEIRO, L. C.; JULIATTI, F. C. Ensaios cooperativos de controle biológico de Sclerotinia sclerotiorum na cultura da soja: resultados sumarizados da safra 2015/2016. Londrina: Embrapa Soja, 2016b. 5 p. (Embrapa Soja. Circular técnica, 124).
MEYER, M. C.; CAMPOS, H. D.; GODOY, C. V.; UTIAMADA, C. M.; DIAS, A. R.; JACCOUD FILHO, D. S.; MEDEIROS, F. C. L.; GALDINO, J. V.; NUNES JUNIOR, J.; SILVA, L. H. C. P.; SATO, L. N.; OLIVEIRA, M. C. N.; MARTINS, M. C.; TORMEN, N. R. Eficiência de fungicidas para controle de mofo-branco (Sclerotinia sclerotiorum) em soja, na safra 2018/19: resultados sumarizados dos experimentos cooperativos. Londrina: Embrapa Soja, 2019. 5 p. (Embrapa Soja. Circular Técnica, 152).
REIS, E. M.; ZANATTA, M.; REIS, A. C. Mofo-branco da soja. Passo Fundo: Berthier, 2019. 96 p.
SAS/STAT®. Versão 9.4 do sistema SAS para Windows. Cary, NC: SAS Institute Inc., 2016.
SHAPIRO, S. S.; WILK, M. B. An analysis of variance test for normality. Biometrika, v. 52, p. 591-611, 1965.



