Autores:
- Eng. Agrônomo, Dr. Alfredo Junior Paiola Albrecht – Universidade Federal do Paraná
- Eng. Agrônomo, Dr. Leandro Paiola Albrecht – Universidade Federal do Paraná
Introdução e contextualização inicial
O capim-amargoso (Digitaria insularis) é uma planta nativa das regiões tropicais e subtropicais da América (Veldman e Putz, 2011), encontrada do Sul dos Estados Unidos até o Norte das planícies dos Pampas, na Argentina. No Brasil, ocorre com grande intensidade nas regiões sudeste, centro-oeste e nordeste (Moreira e Bragança, 2010; Lorenzi, 2014; Carvalho e Nicolai, 2016). Espécie com grande agressividade e rusticidade, que ocupa os mais diversos sistemas produtivos e vem se adaptando a diversas condições (Figura 1).
O capim-amargoso é uma gramínea perene, entouceirada e que se desenvolve em áreas cultivadas, de pastagens, terras abandonadas, terrenos baldios e margens de rodovias. Apresenta caule subterrâneo do tipo rizoma (morfologicamente semelhante ao colmo) e colmos aéreos, cilíndricos e canaliculados com até 1 m de altura, pouco ou nada ramificado (Machado et al., 2008; Moreira e Bragança, 2010; Lorenzi, 2014). Folhas com bainha aberta que envolvem quase todo o entrenó, lígula membranácea curtíssima e colar evidente. Lâmina linear lanceolada com pelos esparsos em ambas as faces e margens finamente serrilhadas (Moreira e Bragança, 2010; Lorenzi, 2014). Na Figura 2 encontram-se detalhes da planta.
A inflorescência do capim-amargoso é do tipo panícula ramificada e terminal, constituída por numerosas espigas, compressas quando jovens e, dilatadas e pendentes para um lado quando adultas. Espigas de coloração branco-prateada contendo numerosas espiguetas rodeadas por pelos sedosos. A planta pode ser reconhecida em campo por meio da inflorescência ampla, pendente e de coloração branco-prateada na maturação. Fruto do tipo cariopse, o qual é uma das unidades de dispersão juntamente com a fragmentação do rizoma (Moreira e Bragança, 2010).
O capim-amargoso é uma espécie de enorme capacidade adaptativa e grande produção de propágulos (Figura 3). As plantas de capim-amargoso podem se reproduzir de forma assexuada pela fragmentação do rizoma, ou de forma sexuada pela elevada produção de sementes (Machado et al., 2008; Gemelli et al., 2012), com número de sementes estimado em até 75 mil por ano de acordo com estudos técnicos realizados em 2020 pela equipe Supra Pesquisa.
Quanto à germinação das sementes do capim-amargoso, observa-se preferência da espécie pela condição de alternância de temperatura (noite-dia), com temperatura ótima da ordem de 25ºC (Oreja et al., 2017) ou 35ºC (Mendonça et al., 2014). Temperaturas de 45ºC inibem completamente a germinação (Mendonça et al., 2014). A ausência de luz não é um fator limitante à germinação (Mondo et al. 2010; Martins et al., 2017). Nesse sentido, a germinação das sementes é mais intensa no período de primavera e verão (Carvalho e Nicolai, 2016).
Em relação à profundidade, as sementes de capim-amargoso apresentam maior porcentagem de germinação na superfície do solo, contudo plântulas podem emergir de até 7,6 cm de profundidade (Zambão et al., 2020).
O capim-amargoso realiza fotossíntese pelo ciclo C4, com estrutura de Kranz e bainha simples, o que é extremamente favorável ao seu desenvolvimento em ambientes quentes e/ou com menor disponibilidade hídrica (Machado et al., 2006). Quanto ao crescimento da espécie, há contraste nos resultados encontrados na literatura, evidenciando a influência da temperatura e fotoperíodo, ou mesmo esclarecendo definitivamente questões como a influência da soma térmica no desenvolvimento do capim-amargoso.
O presente informativo tem como abordagem relatar o trabalho de mapeamento e pesquisa agronômica realizados durante três anos agrícolas (safras 2017/18, 2018/19 e 2019/20) com a espécie Digitaria insularis, conduzido pelo Supra Pesquisa – UFPR Palotina, em parceria com o HRAC-BR.
Mapeamento da resistência do capim-amargoso e sua importância
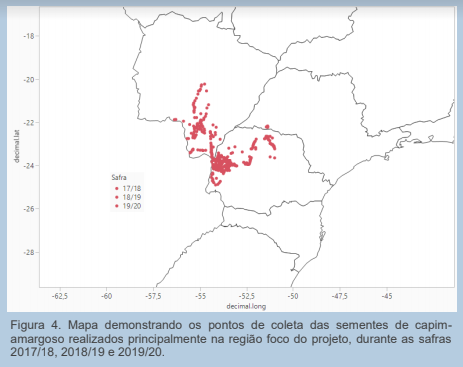
O mapeamento incluiu principalmente coletas no Oeste do estado do Paraná e Sul do estado do Mato Grosso do Sul, e contou com o apoio significativo do HRAC-BR, Cooperativas, órgãos do setor público e especialmente os produtores rurais. Na Figura 4 pode ser visualizada a região de concentração das coletas de sementes.
 A pressão de seleção das plantas daninhas por determinados herbicidas, gera enormes desafios no campo, que evidencia a necessidade de boas práticas agrícolas e desperta pesquisa dirigida na resolução dos problemas. Assim, na Figura 5 é possível observar uma área com infestação de capim-amargoso dentro da cultura da soja, sendo estas plantas provenientes de “escapes” na dessecação desta daninha. Já na Figura 6, é possível notar uma área que ficou em pousio cerca de 60 dias, após a colheita da soja.
A pressão de seleção das plantas daninhas por determinados herbicidas, gera enormes desafios no campo, que evidencia a necessidade de boas práticas agrícolas e desperta pesquisa dirigida na resolução dos problemas. Assim, na Figura 5 é possível observar uma área com infestação de capim-amargoso dentro da cultura da soja, sendo estas plantas provenientes de “escapes” na dessecação desta daninha. Já na Figura 6, é possível notar uma área que ficou em pousio cerca de 60 dias, após a colheita da soja.
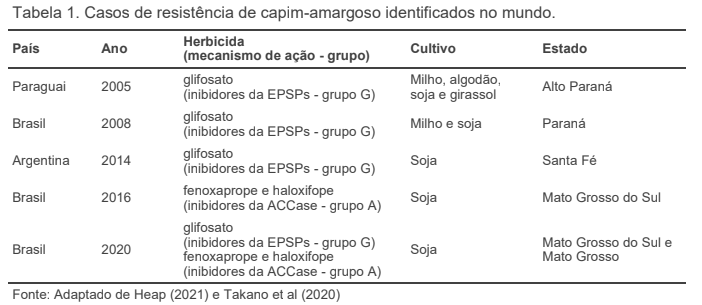
O capim-amargoso tem alta adaptabilidade, agressividade, grande distribuição geográfica (apesar de ser uma gramínea tropical), propagação acentuada e perenização no ambiente produtivo (entouceira e gera rizomas), que por si só já causam atenção e ainda se somam a conhecida resistências do capim-amargoso ao glifosato, além de caso levantado de resistência a inibidores da ACCase, e recentemente a resistência múltipla a glifosato e inibidores da ACCase (Tabela 1).
A região Oeste do Paraná está entre as regiões com primeira identificação e acompanhamento de resistência ao glifosato que somada a região Sul do MS e Paraguai, enfrenta recorrentes problemas no controle desta planta daninha.
Mapeamento da resistência de capim-amargoso a herbicidas durante as safras 2017/18, 2018/19 e 2019/20
Após os três anos agrícolas de condução das pesquisas de mapeamento para prováveis resistências do capim-amargoso à herbicidas, foram avaliados um total de 502 populações, em três estados brasileiros (MS, PR e SP), todavia com maior incidência de coleta no Oeste do PR e Sul do MS (Figura 4).
As coletas seguiram metodologia proposta por Burgos et al., (2013) com adaptações, em que se coletaram sementes de uma ou mais plantas, provenientes de falhas de controle, localizadas em um mesmo ponto, apresentando características similares. Também foram coletadas algumas amostras em áreas com pouca utilização de herbicidas visando encontrar plantas suscetíveis. Os materiais de campo foram acondicionados em ambiente refrigerado e avaliadas em condição controlada em casa de vegetação.
Foi realizada triagem das populações, em casa-de-vegetação, com aplicações dos herbicidas glifosato, haloxifope, cletodim e glufosinato, em doses recomendadas em bula (Figura 7). As plantas de capim-amargoso não controladas após aplicação dos referidos herbicidas foram cultivadas para reprodução (produzindo a geração F1) e suas sementes permitiram a origem de biótipos, nos quais os mesmos herbicidas listados acima foram utilizados, em fracionamento de doses, aplicando-se curvas dose-resposta (Figura 8). Destaca-se que as aplicações sempre foram realizadas quando as plantas apresentavam de um a três perfilhos.
Os fracionamentos das doses dos herbicidas seguiram as proporções de 0X, 1/8X, 1/4X, 1/2X, 1X, 2X, 4X e 8X. Foram aplicados os herbicidas: glifosato (0, 90, 180, 360, 720, 1.440, 2.880 e 5.760 g ea ha-1); cletodim (0, 12, 24, 48, 96, 192, 384, 768 g ia ha-1); haloxifope (0, 7,5, 15, 31, 62, 124, 248, 496 g ia ha-1) e glufosinato (0, 50, 100, 200, 400, 800, 1.600 e 3.200 g ia ha-1). No caso do cletodim, haloxifope e glufosinato, seguiram com a adição dos adjuvantes recomendados em bula.. A dose de 1X, para cada herbicida, representam as doses médias recomendadas em bula.
Tanto na triagem quanto no estudo de curvas dose-resposta, o controle das plantas foi avaliado aos 7, 14 e 28 dias após a aplicação (DAA). Foram atribuídas notas visuais a cada unidade experimental, em que 0 representa nenhum dano e 100% indica a morte total das plantas (Velini et al., 1995). A avaliação da massa seca foi realizada aos 28 DAA dos herbicidas. Os modelos utilizados para obter C50 (eficácia visual de controle de 50% das plantas) e GR50 (redução de 50% da massa seca das plantas) e fator de resistência (FR) foram os mesmos utilizados por Takano et al., 2016; Takano et al., 2017; Albrecht et al., 2020.
A partir do estudo das 502 amostras avaliadas , os resultados demonstraram ausência de resistência ao herbicida glufosinato. No entanto, para o glifosato 96,6% das amostram evidenciaram resistência, totalizando 485 biótipos estudados (Figura 9).
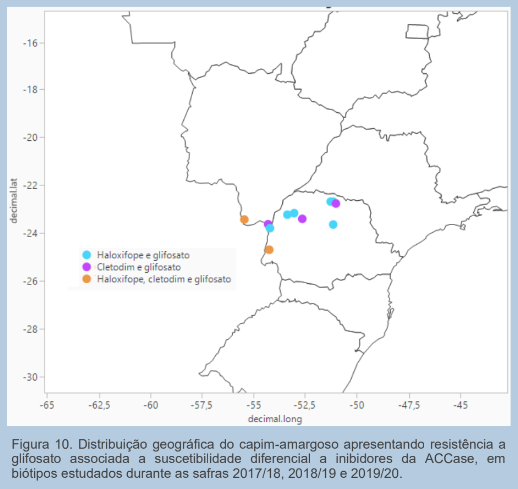
Além da resistência a glifosato alguns biótipos apresentaram também suscetibilidade diferencial para haloxifope e, ou cletodim. Foi verificada a existência de 1,8% dos biótipos com suscetibilidade diferencial a haloxifope, totalizando nove biótipos. Em que um biótipo apresentou suscetibilidade diferencial a haloxifope e ausência de resistência a glifosato, seis biótipos apresentaram suscetibilidade diferencial a haloxifope e resistência a glifosato e 2 biótipos apresentaram suscetibilidade diferencial a haloxifope, cletodim e resistência a glifosato. Já falando de cletodim, ao todo 1,0% dos biótipos apresentam suscetibilidade diferencial a este herbicida, totalizando cinco biótipos, em que os dois biótipos supramencionados apresentaram também suscetibilidade diferencial a haloxifope e resistência a glifosato e três biótipos apresentaram suscetibilidade diferencial a cletodim e resistência a glifosato (Figura 9).
Já na Figura 10 podemos verificar a distribuição geográfica dos pontos onde foram coletadas sementes dos biótipos que apresentaram resistência a glifosato e suscetibilidade diferencial para haloxifope e/ou cletodim.
A partir das curvas de dose resposta, foi possível verificar que para o herbicida haloxifope se teve C50 próximo a 10 g i.a. ha-1 e GR50 próximo a 75 g i.a. ha-1 para os biótipos suscetíveis, e C50 próximo a 30 g i.a. ha-1 e GR50 próximo a 200 i.a. ha-1 para os biótipos com suscetibilidade diferencial, sendo observados FR de aproximadamente três para C50 e FR próximos a 2,5 para GR50. Para cletodim os valores foram, C50 próximos a 15 g i.a. ha-1 e GR50 próximos a 130 g i.a. ha-1 para os biótipos suscetível, e C50 próximos a 50 g i.a. ha-1 e GR50 próximos a 350 g i.a. ha-1 para os biótipos com suscetibilidade diferencial, sendo observado FR também de aproximadamente 3 para C50 e FR e 2,5 para GR50. Já para glifosato podemos observar valores com maiores expressões, com C50 próximos de 90 g e.a. ha-1 e GR50 próximos a 300 g e.a. ha-1 para os biótipos suscetíveis, e C50 próximos a 1000 g e.a. ha-1 e GR50 próximos a 5000 g e.a. ha-1, para os biótipos resistentes, sendo observados FR de cerca de 10 para C50 e FR cerca de 20 para GR50.
Para maior compreensão da suscetibilidade diferencial para haloxifope e cletodim aqui exposta, foi utilizado o conceito de resistência, com base na dose necessária para fornecer pelo menos 80% de controle de um biótipo suspeito (C80). Este raciocínio foi utilizado em artigos recentes abordando a problemática da resistência no Brasil, em que se discutia que para um biótipo seja considerado resistente, o RF deve ser > 1,0 e o C80 > que a dose recomendada do herbicida (Takano et al., 2016; Takano et al., 2017; Albrecht et al, 2020). Assim, para este estudo, os valores de C80 dos biótipos com suscetibilidade diferencial a haloxifope e cletodim foram respectivamente próximos a: 85; e 125 g ha-1. Assim, mesmo com o RF maior que 1, o C80 não ultrapassa a máxima dose recomendada, em algumas bulas dos herbicidas haloxifope e cletodim, para controle de capim-amargoso (Agrofit, 2021). Desta forma não sendo então compreendido como casos de resistência agronômica a estes inibidores da ACCase, mas sim um alerta a grande pressão de seleção que esta ocorrendo.
Após estes três anos de mapeamento de resistência do capim-amargoso a estes herbicidas, foi possível compreender também alguns problemas, distinguindo casos resistência de outras situações que provocaram controle indesejado. Observa-se, nesse contexto, que muitas falhas de controle observadas são originárias, de aplicações executadas em condições ambientais desfavoráveis ou em plantas perenizadas (entouceiradas e rizomatosas, fora do estádio recomendado para aplicação), ou ambas as situações, ou ainda em alguns casos, na utilização de subdoses ou misturas antagônicas de herbicidas, somadas na mesma condição de aplicação. Estes cenários aceleram o processo de pressão de seleção o que já é evidenciado pelos casos de suscetibilidade diferencial, que são plantas que poderão necessitar de doses altas para o seu controle e resultarem em resistências múltiplas em breve.
Cenários progressivos como esse, levantam novas questões, que precisam ser melhores elucidadas em pesquisas futuras, algumas delas já em andamento, na continuidade da parceria entre Supra Pesquisa – UFPR Palotina e HRAC-BR.
Destaca-se ainda que a realização do mapeamento de resistência de plantas daninhas, trata-se assim de uma prática essencial para que possa entender, identificar e quantificar a frequência dessas plantas com antecedência (Schultz et al., 2015; Zabala et al., 2019), propondo o melhor manejo antes da possível perda de ferramentas importantes no mercado agrícola.
Considerações Finais
Desta forma entende-se que o capim-amargoso é uma planta de alta complexidade para seu manejo, considerando sua biologia e a crescente expansão da resistência a herbicidas, dificultando seu controle principalmente em pós-emergência . Nesse sentido, deve-se enfatizar a adoção da boas práticas agrícolas baseada no manejo integrado de plantas daninhas (MIPD), recomendadas pelo HRAC-BR e profissionais da área de manejo de plantas daninhas. A seguir, cita-se as recomendações para manejo de resistência de plantas daninhas segundo o HRAC-BR:
- Evite o pousio sem cultura de cobertura e realize o manejo de plantas remanescentes;
- Comece a semeadura no limpo (utilize herbicidas e, ou culturas de cobertura);
- Conheça as plantas daninhas, os herbicidas recomendados e identifique os casos de resistência;
- Use o benefício dos herbicidas pré- emergentes, pois são muito importantes.
- Aplique os herbicidas dentro das especificações contidas na bula (RESPEITE SEMPRE A BULA);
- Sempre que possível utilize herbicidas com diferentes mecanismos de ação. Faça rotação de ativos;
- Use sementes certificadas;
- Plante na época correta, para melhor competitividade da cultura;
- Utilize o potencial de supressão pelas plantas cultivadas;
- Elimine os escapes;
- Faça rotação de culturas;
- Revise o maquinário. Faça a calibração adequada, incluindo os filtros e pontas dos pulverizadores;
- Limpe os equipamentos antes da utilização ou mudança de área;
- Utilize a Tecnologia de aplicação e formulações em benefício da eficiência;
- Utilize distintas ferramentas para proteger os herbicidas e aumentar a longevidade de sua lavoura.
Com isso, atitudes que evitam o estabelecimento, bem como a perenização do capim-amargoso e incremento de sua resistência, podem propiciar no impedimento de perdas ao agronegócio e geram horizontes de soluções legítimas para a lavoura, são bem-vindas. Ressaltando que são ações que exigem envolvimento técnico e atenção aos detalhes, bem como planejamento para adoções e implementações.
Referências Bibliográficas
Agrofit. Sistema de agrotóxicos fitossanitários. Disponível em: http://agrofit.agricultura.gov.br/agrofit_cons/principal_agrofit_cons. Acessado em 20 fev. 2021
Albrecht, A. J. P., Pereira, V. G. C., Souza, C. N. Z., Zobiole, L. H. S., Albrecht L. P., & Adegas, F. S. (2020). Multiple resistance of Conyza sumatrensis to three mechanisms of action of herbicides. Acta Scientiarum. Agronomy, 42, p. e42485.
Burgos, N.R., Tranel, P.J., Streibig, J.C., et al. (2013) Confirmation of resistance to herbicides and evaluation of resistance levels. Weed Science, 61, 4-20.
Carvalho, S. J. P., & Nicolai, M. (2016). Problemática do capim-amargoso (Digitaria insularis (L.) Fedde) em áreas agrícolas brasileiras. Paulínia: HRAC-BR.
Gemelli, A., Oliveira Júnior, R. S., Constantin, J., Braz, G. B. P., Campos Jumes, T. M., de Oliveira Neto, A. M., … & Biffe, D. F. (2012). Aspectos da biologia de Digitaria insularis resistente ao glyphosate e implicações para o seu controle. Revista Brasileira de Herbicidas, 11(2), 231-240.
Heap, I. (2021). The international herbicide-resistant weed database. Disponível em: www.weedscience.org. Acessado em: 05 de abr. 2021.
Lorenzi, H. (2014). Manual de identificação e controle de plantas daninhas: plantio direto e convencional. 7a ed. Nova Odessa: Instituto Plantarum.
Machado, A. F. L., Ferreira, L. R., Ferreira, F. A., Fialho, C. M. T., Tuffi Santos, L. D., & Machado, M. S. (2006). Growth analysis of Digitaria insularis. Planta Daninha, 24(4), 641-647.
Machado, A. F. L., Meira, R. M. S., Ferreira, L. R., Ferreira, F. A., Tuffi Santos, L. D., Fialho, C. M. T., & Machado, M. S. (2008). Anatomical characterization of the leaf, stem and rhizome of Digitaria insularis. Planta Daninha, 26(1), 1-8.
Marques, B. S., Silva, A. P. P., Lima, R. S. O., Machado, E. C. R., Gonçalves, M. F., & Carvalho, S. J. P. (2014). Growth and development of sourgrass based on days or thermal units. Planta Daninha, 32(3), 483-490.
Martins, J. F., Barroso, A. A. M., & Alves, P. L. C. A. (2017). Effects of environmental factors on seed germination and emergence of glyphosate resistant and susceptible sourgrass. Planta Daninha, 35, p.e017164499.
Mondo, V. H. V., Carvalho, S. J. P., Dias, A. R., & Marcos Filho, J. (2010). Light and temperature effects on the seed germination of four Digitaria weed species. Revista Brasileira de Sementes, 32(1), 131-137.
Moreira, H. D. C., & Bragança, H. B. N. (2010). Manual de identificação de plantas infestantes: cultivos de verão. Campinas: FMC.
Oreja, F. H., De la Fuente, E. B., & Fernandez-Duvivier, M. E. (2017). Response of Digitaria insularis seed germination to environmental factors. Crop and Pasture Science, 68(1), 45-50.
Schultz, J.L., Chatham, L.A., Riggins, C.W., Tranel, P.J., and Bradley, K.W. (2015) Distribution of herbicide resistances and molecular mechanisms conferring resistance in Missouri waterhemp (Amaranthus rudis Sauer) populations. Weed Science, 63, 336-345.
Takano, H.K., Oliveira Júnior, R.S., Constantin, J., Braz, G.B.P, Franchini L.H.M. and Burgos, N.R. (2016) Multiple resistance to atrazine and imazethapyr in hairy beggarticks (Bidens pilosa). Ciência e Agrotecnologia, 40, 548-554.
Takano, H.K., Oliveira Júnior, R.S., Constantin, J., Braz, G.B.P. and Gheno, E.A. (2017) Goosegrass resistant to glyphosate in Brazil. Planta Daninha, 35, p.e017163071.
Veldman, J. W., & Putz, F. E. (2011). Grass-dominated vegetation, not species-diverse natural savanna, replaces degraded tropical forests on the southern edge of the Amazon Basin. Biological Conservation, 144(5), 1419-1429.
Velini, D.E., Osipe, R. and Gazziero, D.L.P. (1995) Procedimentos para instalação, avaliação e análise de experimentos com herbicidas. Londrina: SBCPD.
Zambão, J., Bittencourt, H. H, Bonome, L. T. S., Trezzi, M. M., & Fernandes, A. C. P. P. (2020). Water restriction, salinity and depth influence the germination and emergence of sourgrass. Planta Daninha, 38, e020222729.
Zabala, D., Carranza, N., Darghan, A., and Plaza, G. (2019) Spatial distribution of multiple herbicide resistance in Echinochloa colona (L.) Link. Chilean Journal of Agricultural Research, 79, 576-585.