Autores: Erlei Melo Reis, Andrea Camargo Reis e Mateus Zanatta
Esse texto foi escrito para reforçar a citação de Behe (1977) de que “a ciência sem números não tem valor ou não existe”. Portanto, se entende que na escrita científica deve ser evitado o uso de adjetivos. Além disso, Behe lembra também que “o que não se publica não foi feito ou não existe”!
A doença alvo dessa revisão recebe o nome comum de ‘mofo-branco’ pela formação de uma massa algodonosa branca nos órgãos atacados, principalmente nas hastes (Fig. 1).

A soja [Glycine max (L.) Merr.] é muito importante ao agronegócio brasileiro. A área cultivada na safra 2020/21, foi de 38,3 milhões de hectares (Conab, 2021).
O fungo agente causal, atualmente denominado de Sclerotinia sclerotiorum (Lib.) De Bary, foi descrito pela primeira vez na Bélgica pela senhorita M. A. Libert em 1837, como Peziza sclerotiorum (apud Bolton et al., 2006).
O mofo-branco foi relatada no Brasil, em 1921, por Rosário Averna Saccá, então professor de fitopatologia da ESALQ – USP, Piracicaba, na cultura da batata em São Paulo (apud Chaves, 1964) e em soja, o primeiro relato foi feito na década de 1970, no Paraná, por Yamashita et al. (1978).
O fungo apresenta várias formas ao longo de seu ciclo de vida cada uma com função definida (Fig. 2).
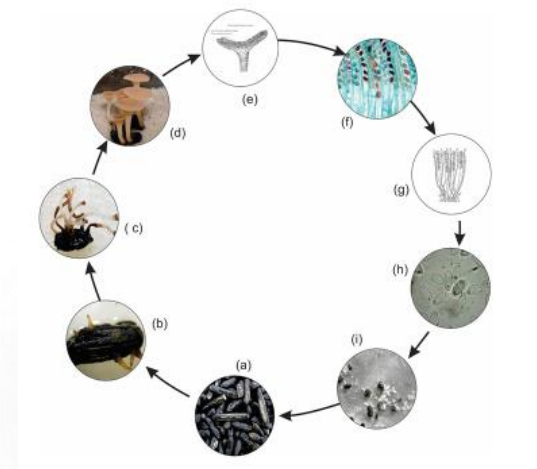
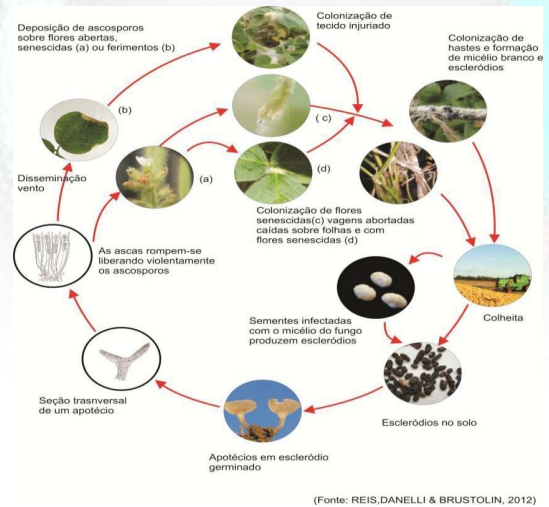
Ciclo da doença. As fases do ciclo do mofo-branco, em soja, são descritas na Figura 3.
Gama de hospedeiros. Uma característica marcante na ecologia desse fungo é a vasta gama de hospedeiros (Purdy, 1979). No site, nt.ars-grin.gov/fungaldatabases/index.cfm, são listados 652 hospedeiros de S. sclerotiorum.
Na safra 2018/19, a área de soja infestada pelo fungo atingiu 10 milhões de hectares (Meyer et al., 2018).
Dano. A ferrugem asiática da soja é a doença que mais danos causas à cultura e o mofobranco é a segunda. A função matemática para estimar o dano causado em lavouras é R = 1000 – 7,23 IP, onde R é o rendimento de grãos normalizado para 1,000 kg/ha e ‘IP’ a incidência na haste principal em plantas (Reis et al., 2020).
Uso da equação. Tome-se como exemplo uma lavoura de soja com potencial de rendimento de 3.050 kg/ha e tendo uma incidência de 27% de plantas atacadas (IP) pelo mofobranco. O dano pode ser calculado com a equação acima citada. Segundo a equação para cada 1000 kg de grãos de soja uma incidência de 1%, reduz 7.23 kg/ha. Portanto, em 3050 kg/ha, 1%, reduz 22,05 kg/ha e 27% de incidência reduz 595,39 kg/ha.
Micélio. O micélio do fungo é hialino, septado, com células multinucleadas, podendo cada compartimento conter mais de 100 núcleos por célula (wong & Willett,1979). O micélio pode permanecer viável em flores colonizadas por até 144 horas, na ausência de condições ambientas desfavoráveis e após com ambiente favorável retomar sua atividade (Harikrishnan & Del Rio, 2006).
O micélio do fungo se desenvolve numa faixa térmica de 18 a 25oC, sendo a ótima de 20ºC. (Boland & Hall, 1987).
Escleródios. A forma e o tamanho dos escleródios são muito variados. Essas estruturas de repouso ou de dormência, negras e duras, podem atingir até 5 cm de comprimento quando formados na medula da haste da soja (Fig. 4).

O número escleródios por planta pode ser de até 41 (José Alencar, informação pessoal) e quanto a sua densidade no solo tem sido quantificado até 136/m2, na camada superficial de 5 cm de espessura (Görgen et al.,2009).
Uma informação importante foi relatada por Huang (1981) de que os escleródios podem germinar miceliogenicamente e produzirem escleródios secundários, mantendo e aumento o banco de inóculo primário no solo.
Longevidade. Quanto a longevidade dos escleródios no solo os dados são muito discrepantes. Quanto mais antiga for citação da pesquisa, mais longo o tempo chegando até a 11 anos. Porém, com pesquisas mais recentes esse período vem sendo reduzido. A longevidade em solos de lavouras pode atingir 35 meses enterrados a 10 cm de profundidade e 12 a 14 meses quando na superfície do solo (Reis e Tomazini, 2005; Brustolin et al., 2016).
Germinação. Dois fatores ambientais exercem efeito marcante na germinação dos escleródios:
- A água que quebra sua dormência e o processo ocorre numa faixa térmica de 4 a 20ºC. A completa hidratação dos escleródios ocorre dentro de quatro horas quando imersos na água. Segundo o relato de (Abawi & Grogan 1979), são necessários no mínimo 10 dias de molhamento foliar contínuo para ocorrer, numa lavoura, a germinação carpogênica;
- A temperatura ótima para a germinação carpogênica situa-se na faixa de 10 a 20ºC, com a máxima a 15ºC (Abawi and Grogan 1979; Clarkson et al. 2004).
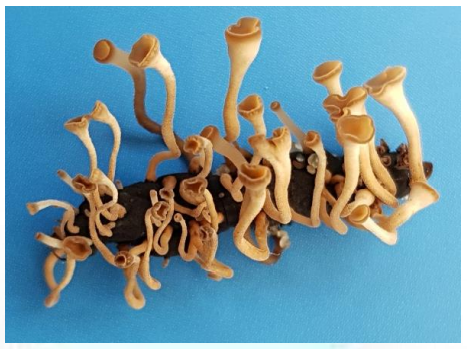
Estipes. Os escleródios germinam dando origem aos estipes (Fig. 5), fotototrópicos e quando expostos à luz, especialmente a ultravioleta (<390 nm), diferenciam-se em apotécios. Medem até 5 cm de comprimento quando os escleródios se encontram enterrados e mais curtas quando na superfície do solo.

Um escleródio, medindo 20 x 3,5 mm, pode produzir até 53 estipes (José Alencar, informação pessoal) (Fig. 6).

Apotécios. Segundo Clarkson et al. (2003), a condição ótima no solo para a formação de apotécios ocorre quando, por um período de 10 a 14 dias, o teor de água for maior do que 50% da saturação e a temperatura de 15°C a 17,8°C, contudo, podem ser formados em solos com temperaturas entre 4,4°C a 30°C, o que significa que podem ser produzidos ao longo de todo o período vegetativo e reprodutivo das culturas de verão e de inverno, no Brasil.
Os escleródios recém-formados, posicionados a profundidade de 1,0 cm, formam apotécios a partir de 45 dias. Para isso, o solo deve ter teor de água favorável e temperatura média de 15 a 20°C.
Os apotécios apresentam diâmetro de 2 a 10 mm (Fig. 7).

O número de apotécios formados por escleródio é variável (Fig. 8).
Luz. A intensidade da luz tem efeito no tempo de formação dos apotécios. Os estipes, quando expostos à luz, especialmente a ultravioleta, diferenciam sua extremidade apical em apotécios sob temperatura de 15 a 20ºC. Honda & Vunoki (1977) citam que os comprimentos de onda de 276 a 319 nm são necessários para a formação normal de apotécios. Outra fonte cita que fotoperíodo de 14h/dia tendo como fonte luz fluorescente fornecendo 8.800 a 9.620 lux dentro dos gerboxes favorece a germinação (Yang et al., 1998).
Ascas. As ascas, no interior dos apotécios, são cilíndricas com dimensões de 125 – 130 x 8 -10 µm. Em cada uma, são produzidos oito ascosporos hialinos, elipsóides e binucleados (Bolton et al., 2006).
Ascosporos. Os ascosporos, presentes nas ascas, são unicelulares e em número de oito em cada asca, medem 4 – 6 x 9 – 13 µm (Hanlin & Menezes, 1996).
Potencial de esporulação. Diversas fontes referem-se à quantificação da produção de esporos:
- Cada apotécio pode produzir cerca de 2,3 x 106 ascosporos em condições controladas (Schwartz & Steadman, 1978);
- Os apotécios podem produzir até 3 × 107 ascosporos (Kora et al. (2003);
- Outra citação reporta que um apotécio pode produzir 7,6 x 105 ascosporos em 20 dias ou 1.600 ascosporos por apotécio por dia (Clarkson et al., 2003);
- Cada apotécio pode produzir de 2 até 30 milhões de ascósporos durante um período de até 10 dias (Venette, 1998; Clarkson et al., 2003);
- Sob condições ambientais ideais, cerca de 1.600 esporos são liberados por hora na faixa térmica de 3ºC a 22ºC, com mais intensidade entre 19ºC e 20ºC e maior pico das 9:00 as 13:00 h (Kora et al., 2003).
Balistosporia. Os apotécios podem permanecer funcionais, no campo, por um período de 5 a 10 dias (Kora et al. (2003). Outras fontes citam que podem, em média, liberar ascosporos um período de 9 dias (Schwartz & Steadman 1978), ou ser tão longo quanto 20 dias (Clarkson et al. 2003). Clarkson et al. (2003) observaram que a liberação de ascosporos ocorre tanto durante o dia quanto à noite havendo declínio quando a umidade relativa do ar atinge valores entre 65 e 75%.
Distância do transporte anemófilo dos ascosporos. Segundo Steadman (1983) a distância do deslocamento anemófilo dos esporos pode ser de até 100 m., Porém, no relato de Qandah e Del Rio Mendoza (2012), de até 60 m. Se pode deduzir que os ascosporos que infectam a soja tem origem principalmente dentro da lavoura.
No relato de Williams & Stelfox (1989), os ascosporos foram capturados em placas com ágar a uma altura de 150 cm sobre a superfície do solo em áreas com a presença de apotécios.
Sobrevivência. O fungo sobrevive em sementes infectadas de qualquer espécie vegetal. No caso da soja, o período de armazenamento é de 6 – 7 meses, após, se não forem semeadas, são comercializadas.
Como as sementes introduzem o patógeno em lavouras. Na cultura do feijoeiro, as sementes infectadas não germinam, podendo formar de 3 a 6 escleródios por semente apodrecida no solo (Tu, 1988). E em soja, Yang et al. (1998) citam de 1,0 a 2,0 e Brustolin et al. (2011) relataram a formação de 1,8 escleródios por sementes apodrecida.
Densidade de escleródios no solo. Görgen et al. (2009) relataram até 136 escleródios/m2 de solo numa camada de 5,0 cm de espessura. Cerca de 90% do tempo de duração do ciclo do fungo é na forma de escleródio (Adams & Ayres, 1979).
Infecção da planta de soja. O sucesso da infecção depende da duração do período de molhamento contínuo dos sítios de infecção e da temperatura nesse período.
- A temperatura catalisa a velocidade do processo de germinação dos esporos e penetração do pró-micélio nos tecidos do hospedeiro. A germinação máxima dos ascosporos ocorre dentro de 8 horas a 21ºC.
- A presença da água líquida é fator determinante para a germinação dos ascosporos e penetração da flor senescida e de ferimentos (Turkington & Morral, 1993. Para a infecção são requeridas de 40 a 120 horas de molhamento contínuo dos sítios de infecção (Boland e Hall, 1987), com média de 50 horas. A duração longa desse molhamento é resultante de chuvas; Um período de molhamento contínuo das haste e 42 a 78 horas é necessária a infecção e a expansão das lesões em canola (Tu 1989).
Cerca de 90% das infecções surgem no 3º – 4º nós basais da haste principal (observação pessoal).
Importância da semente infectada. O principal agente de disseminação direta do patógeno é a sementes infectada. A incidência de S. sclerotiorum em sementes é muito baixa.
- Hoffman et al (1998), citam 0,25 a 0,7%;
- Brustolin (2011), relatou 0,37%; e
- Henning et al (2011) 0,25%.
Com base em Brustoln (2011) pode-se calcular o número de focos/hectare de lavoura cultivada com sementes infectadas: considerando uma densidade de semeadura da soja de 250.000 sementes por ha e 0,25% de incidência de S. sclerotiorum, tem-se 625 infectadas/ha, cada uma morta e apodrecida no solo produz dois escleródios, totalizam 1.250 por hectare. Calcule o número de apotécios e de esporos produzidos por hectare nessa primeira safra de introdução do fungo na lavoura!
Controle biológico. Mais de 30 espécies de fungos e bactérias são citadas com atividade antagonista à S. sclerotiorum (Adams & Ayers 1979).
Controle químico. No ensaio cooperativo de fungicidas, visando ao controle do mofobranco, a mistura boscalida + demoxistrobina, fluazinam, fluazinam + carbendazim e fluopiram, na média de 11 experimentos, apresentaram controle > 70%. A primeira pulverização foi feita no estádio fenológico R1e a segunda 10 dias após com um volume de calda de 150 L/ha (Meyer et al., 2018).
Bibliografia
ADAMS, P.B.; AYRES, W.A. Ecology of Sclerotinia sclerotiorum species. Phytopathology, St. Paul, v. 69, p. 896-899, 1979.
BEHE, M. A caixa preta de Darwin. Rio de Janeiro. Jorge Zahar Editora Ltda. 300p., 10 1997.
BLAD, B. L., J. R. STEADMAN, J.R.; WEISS, A. Canopy structure and irrigation influence white mold disease and microclimate of dry edible beans. Phytopathology, St. Paul, v 68, p.1431-1437, 1978.
BOLAND, G. J.; HALL, R. Epidemiology of Sclerotinia stem rot of bean in Ontario. Phytopathology, Canadian Journal of Plant Pathology, Otawa, v. 9, p. 218-224, 1987.
BOLAND, G.J.; HALL, R. Index of plant hosts of Sclerotinia sclerotiorum. Canadian Journal of Plant Pathology, Otawa, v.16, p. 91-108, 1994.
BOLAND, G.J.; INGLIS, G.D. Antagonism of white mold (Sclerotinia sclerotiorum) of bean by fungi from bean and rapeseed flowers. Canadian Journal of Plant Pathology, Otawa, v. 67, p. 1775-1781, 1989.
BOLTON, M.D.; THOMMA, B.P.J.; BERLIN, D.N. Sclerotinia sclerotiorum (Lib.) de Bary: biology, and molecular traits of a cosmopolitan pathogen. Molecular Plant Pathology, v.7. n.1. p. 1-16, 2006.
BRUSTOLIN, R.; REIS, E. M.; PEDRON, L. Longevity of Sclerotinia sclerotiorum sclerotia on the soil surface under field conditions. Summa Phytopathologica, Botucatu, v.42, n.2, p.172-174, 2016.
BRUSTOLIN, R., REIS, E.M., PEDRON, L., DE ROSSI, R.L., DANELLI, A.D., ZOLDAN, S.M., VIANA, E., BELEDELLI, G.L., SIQUEIRA, D.D. Produção de escleródios de Sclerotinia sclerotiorum, no solo, a partir de sementes de soja infectadas pelo método de restrição hídrica. Tropical Plant Pathology, Brasília, DF, Bento Gonçalves/RS, v.36, p. 3299, 2011. Suplemento.
CLARKSON, J.P; STAVELEY, J.; PHELPS, K.; YOUNG, C.S.; WHIPPS, J.M. Ascospore release and survival in Sclerotinia sclerotiorum. Mycological Research. 107(2):213-222, 2003. CONAB, levantamento de safras (2021). Available in: https://www.conab.gov.br/infoagro/safras/graos, boletins grãos setembro 2020. Acessed March, 2020.
GÖRGEN, C.A.; SILVEIRA NETO, A.N.; LUCIANA CELESTE CARNEIRO., L.C.; RAGAGNIN, V.; JUNIOR, M. Controle do mofo-branco com palhada e Trichoderma harzianum em soja. Pesquisa agropecuária brasileira, Brasília, DF, v.44, n.12, p.1583-1590, dez. 2009.
HANLIN, R.T.; MENEZES, M. Gêneros ilustrados de ascomicetos. Recife: Imprensa da Universidade Federal Rural de Pernambuco. 1996. 274p.
HENNING, A.A. Importância da colheita, beneficiamento e tratamento com fungicida na sanidade de sementes e transmissão do mofo-branco. In: Simpósio Brasileiro de Patologia de Sementes. Natal, Resumos de paletras. Informativo Abrates, v.21, p. 16, 2011.
HOFFMAN, D. D.; HARTMAN, G. L.; MUELLER, D.M.; LEITZ, R. A.; NICKELL, C. D.; PEDERSEN, W. L.. Yield and seed quality of soybean cultivars infected with Sclerotinia sclerotiorum. Plant Disease, St. Paul, v. 82, p. 826-829, 1998.
KORA, C.; McDONALD, M.R.; BOLAND, G.J. Sclerotinia rot of carrot: an example of phenological adaptation and bicyclic development by Sclerotinia sclerotiorum. Plant Disease, St. Paul, v.87, p.456-470, 2003.
MEYER, M. C.; CAMPOS, H. D.; GODOY, C. V.; UTIAMADA, C. M.; SEII, A. H.; DIAS, A. R.; JACCOUD FILHO, D. S.; BORGES, E. P.; JULIATTI, F. C.; NUNES JUNIOR, J.; SILVA, L. H. C. P. da; SATO, L. N.; MARTINS, M. C.; VENANCIO, W. S. Eficiência de fungicidas para controle de mofo-branco (Sclerotinia sclerotiorum) em soja, na safra 2017/18: resultados sumarizados dos ensaios cooperativos. Londrina: Embrapa Soja, 2018. 5 p. (Embrapa Soja. Circular técnica, 140).
PURDY, L.AH. Sclerotinia sclerotiorum: History, disease and symptomatology, host range, geographic distribution, and impact. Phytopathology, St. Paul, v. 69, p. 875-880, 1979.
QANDAH, I.S.; DEL RÍO MENDOZA, L.E. Temporal dispersal patterns of Sclerotinia sclerotiorum ascospores during canola flowering. Canadian Journal of Plant Pathology, v. 33, v.2, p. 159-167, 2011.
REIS, E. M.; TOMAZINI, S. L. Viabilidade de escleródios de Sclerotinia sclerotiorum, no campo, em duas profundidades do solo. Summa Phytopathologica, Botucatu, v. 31, n. 1, p. 97-99, 2005.
REIS, E.M.; ZANATTA, M.; CAMPOS, H.D.; SILVA L.H.C.P.; MEYER, M.C.; NUNES, J.N.; PIMENTA, C.B.; CASSETARI Neto, D.; MACHADO, A.Q.; JULIATTI, F.C.; UTIAMADA. C.M.. A critical-point yield model to appraise the damage caused to soybean by white-mold. Bioscience Journal, Uberlândia, v. 36, n. 6, p. 1816-1820, Nov./Dec. 2020 http://dx.doi.org/10.14393/BJ-v36n6a2020-55438
SCHWARTZ, H. F.; J. R. STEADMAN. 1978. Factors affecting sclerotium populations of, and apothecium production by Sclerotinia sclerotiorum. Phytopathology, St. Paul, v. 68, p. 383-388, 1978.
SCHWARTZ, M.S.; McMILLAN; OTTO, K.L. Bean white mold – Fungicide decision strategy. Colorado State University.1998. http://www.colostate.edu/Orgs/Vegnet/vegnet/bwmfds.htm
STEADMAN, J.R. White mold – a serious yield-limiting disease of bean. Plant disease, St. Paul, v. 346, p. 4 – 350, 1983.
SUN, O. & YANG, X.B. Ligth, temperature, and moisture effects on apothecium production of Sclerotinia sclerotiorum. Plant Disease, St. Paul, v. 84, p. 1287-1293. 2000.
TOWNSEND, B.B.; WILLETTS, H.J. The development of sclerotia in certain fungi. Transactions of the British Mycological Society. v. 37, p. 213-221, 1954.
TU, J.C. The Role of white mold‐infected white bean (Phaseolus vulgaris L.) seeds in the dissemination of Sclerotinia sclerotiorum (Lib.) de Bary. Journal of Phytopathology v. 121, p. 40-50, 1988.
Williams, J.R.; Stelfox, D. Dispersal of Sclerotinia sclerotiorum in relation to Sclerotinia stem rot of rapessed. Plant Disease Reporter, v. 63, p. 395-399, 1979.
VENETTE, J. Sclerotinia spore formation, transport, and infection. IN: SCLEROTINIA WORKSHOP, 1998, Fargo North Dakota. Proceedings. Fargo North Dakota: North Dakota State University, 1998. P.4-7.
YAMASHITA, J.; NASSER, LC.B.; ALMEIDA, A.M.R.; MACHADO, C.C.; FERREIRA, L.P. Ocorrência da fase perfeita do fungo Whetzelinia sclerotiorum (Lib.) Korf & Dumond, em lavouras de soja no estado do Paraná. Fitopatologia brasileira, Brasília, DF, v.3, n.1., p.109, 1978.
YANG, X.B.; WORKNEH, LUNDEEN, P. First report of sclerotium production by Sclerotinia sclerotiorum in soil on infected soybean seeds. Plant Disease, St. Paul, v. 83, p. 264. 1998.
WILLETTS, H.J.; WONG, J.A.L. The biology of Sclerotinia sclerotiorum, S. trifoliorum, and S. minor on specific nomenclature. Botanical Review. v. 46, n. 2, p.101–165, 1980
WONG, J.A.L., WILLETTS, H. Cytology of Sclerotinia sclerotiorum and related species. J. Gen. Microbiol. v. 112, p. 29–34. 1979.
“Esta é mais uma contribuição científica do Instituto Agris em prol da sojicultura gaúcha”
Fonte: Instituto Agris, Pesquisa e Consultoria Agrícola Ltda.





