O nematoide Aphelenchoides besseyi é o agente etiológico da doença popularmente conhecida como “Soja Louca II”, que causa haste verde e retenção foliar na soja. Sua ocorrência é mais severa em regiões quentes e chuvosas nos estados do Mato Grosso, do Pará, do Amapá, de Tocantins e do Maranhão, causando perdas de até 100% do rendimento da soja nas áreas mais atacadas da lavoura (Meyer et al., 2017b).
As mais de 150 espécies descritas do gênero Aphelenchoides apresentam forma de vida livre no solo e são micófagas, ou seja, alimentam-se de fungos habitantes de solo. Poucas espécies desse gênero, como Aphelenchoides fragariae, Aphelenchoides ritzemabosi e Aphelenchoides besseyi, comportam-se como fitonematoides, parasitando a parte aérea de algumas plantas cultivadas e hospedeiras alternativas, sendo chamados de nematoides aéreos ou foliares.
Dentre as culturas mais afetadas, destacam-se o arroz, o morango, as plantas ornamentais, as forrageiras e, mais recentemente, o feijão, a soja, o algodão e o feijão-caupi (Kohl, 2011; Chaves et al., 2013; Meyer et al., 2017b; Favoreto et al., 2018a; Favoreto et al., 2018c).
Mesmo desenvolvendo a capacidade de parasitar plantas, essas espécies de Aphelenchoides preservaram suas habilidades de sobrevivência saprofítica e podem sobreviver normalmente no solo, na ausência de plantas hospedeiras, alimentando-se de fungos decompositores de matéria orgânica, ou ainda, em condições extremas, entrar em anidrobiose (estado de redução da atividade metabólica, decorrente da ausência ou diminuição de água no ambiente) e assim sobreviver por meses no interior de restos culturais ou em sementes de arroz e de espécies forrageiras (Favoreto et al., 2011; Ferraz; Brown, 2016).
Aphelenchoides besseyi se multiplica rápida e eficientemente no interior dos tecidos das hospedeiras. Sua disseminação entre plantas na lavoura pode ocorrer pelo contato entre folhas das plantas doentes com plantas sadias, desde que haja presença de água livre, seja pelos respingos de chuva ou mesmo pelo orvalho noturno. É possível também que o nematoide possa se espalhar mais uniformemente numa área de produção pelos resíduos de plantas doentes expelidos pelas colhedoras, aliado à ação dos ventos (Favoreto et al., 2011; Ferraz; Brown, 2016).
Descrição do patógeno
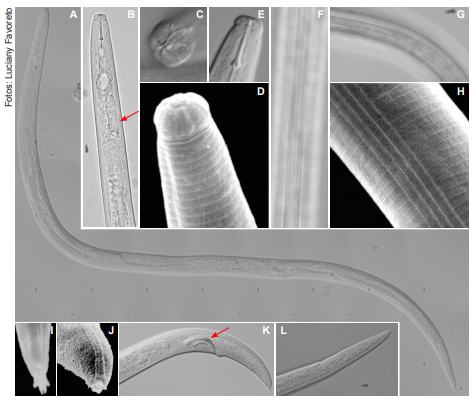
As fêmeas e os machos de A. besseyi são filiformes (Figura 1A), possuem região labial alta, destacada do corpo, arredondada, lisa e hexarradiada (Figuras 1A, 1B, 1C e 1D); estilete delicado e curto, com nódulos basais pequenos (Figura 1E); esôfago com bulbo mediano bem distinto (seta da Figura 1B); o campo lateral têm aproximadamente 1/4 da largura do corpo, com quatro linhas (Figuras 1F, 1G e 1H); cauda com término provido de projeções em forma de espinhos, denominados mucros, podendo variar de dois a quatro mucros (Figuras 1I e 1J); geralmente, quando relaxados, a parte final do corpo do macho é curvada e da fêmea é reta (Figuras 1K e 1L); macho com espículos típicos, em forma de espinho de roseira (seta da Figura 1K).
Infecção na planta
Em períodos com elevada frequência de chuvas e temperaturas médias acima de 28°C, os nematoides migram do solo para a parte aérea das plantas de soja no início do desenvolvimento vegetativo.
Em outros patossistemas, a relação parasitária de Aphelenchoides spp. com suas hospedeiras é descrita com ectoparasita, ou seja, o nematoide se desloca externamente à planta por meio de um filme de água.
Estudos do patossistema soja – A. besseyi, conduzidos na Embrapa Soja, indicam que a relação pode ser endoparasitária, com a penetração do nematoide nas raízes e no hipocótilo, e a sua movimentação ascendente até os sítios de alimentação ocorrendo internamente na planta (Favoreto et al., 2018b),mas esses dados ainda não são conclusivos e carecem de mais estudos.
Os principais sítios de alimentação e multiplicação de A. besseyi em soja são os racemos florais (situados nos nós) e as folhas mais jovens, normalmente situadas no topo das plantas. Nesses tecidos mais tenros e ricos em açúcares, os nematoides se alimentam e se multiplicam intensamente, causando lesões necróticas e deformações dos tecidos (Figura 2).

Sintomas
A distribuição de plantas doentes numa lavoura de soja não obedece um padrão definido, podendo ocorrer em reboleiras, em faixas ou distribuídas uniformemente nas lavouras (Meyer et al., 2017b).
Os sintomas são mais evidentes a partir do início do estádio reprodutivo da soja (R1). As plantas afetadas apresentam folhas com coloração verde mais intenso, menor pilosidade, afilamento e embolhamento no limbo foliar (Figuras 3A e 3B) e, algumas vezes, lesões necróticas angulares de coloração pardo avermelhadas a marrons (Figuras 3C e 3D).

As deformações nas hastes são caracterizadas por engrossamento dos nós, caneluras e retorcimento dos entrenós do ápice das plantas (Figura 4).

Ocorre acentuado abortamento de flores e, em alguns casos, rosetamento dos racemos florais. Há redução no número de vagens, e as remanescentes geralmente apresentam deformações e lesões necróticas marrons (Figura 5). Os grãos formados nessas vagens normalmente não maduram, permanecendo verdes e apodrecem com o passar do tempo.

Enquanto as plantas sadias completam o ciclo e atingem o ponto de colheita (R9), as plantas doentes não maturam dentro do ciclo normal da cultura, permanecendo verdes no campo devido à retenção foliar, com folhas, pecíolos e hastes verdes (Figura 6).

Manejo
A redução da população do nematoide da haste verde em áreas infestadas é dependente do manejo cultural adotado, devendo-se programar um eficiente controle de plantas hospedeiras voluntárias e a sucessão de culturas não hospedeiras de A. besseyi.
Uma importante medida de controle é realizar a semeadura da soja sobre a palhada de plantas completamente mortas, devendo-se dessecar a área com antecedência mínima de 15 a 20 dias. O controle de plantas invasoras em pós emergência da soja também deve ser feito logo no início do desenvolvimento das mesmas (Meyer; Klepker, 2015).
Até o momento, foram identificadas as seguintes plantas hospedeiras e boas multiplicadoras de A. besseyi: trapoeraba (Commelina benghalensis), agriãozinho-do-pasto (Synedrellopsis grisebachii), caruru (Amaranthus viridis) e cordão de frade (Leonotis nepetifolia) (Favoreto; Meyer, 2018).
As gramíneas mais utilizadas como fonte de cobertura de solo nas regiões Norte e Nordeste do País ou mesmo como alternativas de produção de grãos, tais como as diversas espécies forrageiras (Urochloa spp., Panicum spp., Pennisetum spp., etc.), milheto (Pennisetum glaucum), sorgo (Sorghum spp.) e milho (Zea mays), não são boas hospedeiras de A. besseyi, mas a palhada pode servir de abrigo e permitir sua sobrevivência na entressafra, quando entram em estado de anidrobiose nos períodos secos, ou podem fornecer alimento para o nematoide em períodos chuvosos, por meio da proliferação de fungos decompositores de matéria orgânica.
Por isso, o utilização do sistema de semeadura direta sobre palha nas regiões de incidência do nematoide da haste verde deve observar uma rigorosa estratégia de manejo de sua população.
Dentre as culturas agrícolas, o algodão (Gossypium hirsutum), o feijão (Phaseolus vulgaris) e o feijão-caupi (Vigna unguiculata) são bons multiplicadores do nematoide e devem ser evitados em áreas de incidência na sucessão da soja (Favoreto; Meyer, 2018).
Ainda não foram encontradas fontes de resistência genética em soja (Meyer et al., 2017a) e a integração de medidas de controle químico e biológico do nematoide será possível no futuro, mas a eficiência e o posicionamento de uso de alguns potenciais nematicidas ainda estão em estudo.
Coleta de amostras para análise nematológica
A qualidade da coleta, do armazenamento e do envio das amostras para o laboratório irá influenciar no resultado das análises. A tesoura de poda ou qualquer outro equipamento utilizado para o corte da planta deve estar e permanecer limpo, durante toda a amostragem, evitando-se contaminação com solo.
Deve-se coletar apenas a parte aérea das plantas doentes, cortando-as cerca de 15 cm acima do nível do solo. Em seguida deve-se separar as folhas sintomáticas do topo da planta (Figura 7A) e os nós (Figuras 7B e 7C), acondicionando-os em sacos plásticos distintos e identificados. Os entrenós e as folhas assintomáticas do baixeiro podem ser descartados.
As amostras adequadamente embaladas deverão permanecer em ambiente fresco, ventilado ou mantidas em geladeira (~4º C) até que seja possível enviá-las ao laboratório. Nunca armazená-las em congelador ou freezer.

O envio das amostras para o laboratório deverá ser realizado o mais breve possível. Durante o transporte, visando retardar a deterioração dos tecidos, as amostras devem ser acondicionadas dentro de caixas térmicas e, se possível, com gelo artificial.
Também, deve-se evitar a exposição das amostras a altas temperaturas, exposição direta ao sol por períodos prolongados, bem como condições que favoreçam perda de umidade, como a manutenção das mesmas no interior de veículos em dias quentes.
Autores:
- Luciany Favoreto, engenheira-agrônoma, doutora em Agronomia, pesquisadora da Epamig Oeste, Uberaba, MG.
- Maurício Conrado Meyer, engeiheiro-agrônomo, doutor em Proteção de Plantas, pesquisador da Embrapa Soja, Londrina, PR.
Foto de Capa: Luciany Favoreto
Referencias
CHAVES, N.; CERVANTES, E.; ZABALGOGEAZCOA, I.; ARAYA, C. M. Aphelenchoides besseyi Christie (Nematoda: Aphelenchoididae), agente causal del amachamiento del frijol común. Tropical Plant Pathology, v. 38, n. 3, p. 243-252, 2013.
FAVORETO, L.; FALEIRO, V. O.; FREITAS, M. A.; BRAUWERS, L. R.; GALBIERI, R.; HOMIAK, J.A.; LOPES-CAITAR, V. R.; MARCELINO-GUIMARÃES, F. C.; MEYER, M. C. First report of Aphelenchoides besseyi infecting the aerial part of cotton plants in Brazil. Plant Disease, v. 102, n. 12, p. 2662, 2018a. DOI: https://doi.org/10.1094/ PDIS-02-18-0334-PDN.
FAVORETO, L.; MEYER, M. C. Diagnose, hospedeiros e manejo de Aphelenchoides besseyi. In: CONGRESSO BRASILEIRO DE NEMATOLOGIA, 35., 2018, Bento Gonçalves, RS. Anais… Brasília: Embrapa, 2018b. p. 60-62.
FAVORETO, L.; SILVA, M. C. M. da; CALANDRELLI, A.; FRANÇA, P. P.; MEYER, M.C. Variabilidade genética em caupi (Vigna unguiculata) para reação à infecção por populações de Aphelenchoides besseyi. In: CONGRESSO BRASILEIRO DE NEMATOLOGIA, 35., 2018, Bento Gonçalves, RS. Anais… Brasília: Embrapa, 2018c. p. 143.
KOHL, L. M. Astronauts of the nematode world: an aerial view of foliar nematode biology, epidemiology, and host range. APSnet Features, 2011. DOI: 10.1094/ APSnetFeature-2011-0111.
MEYER, M. C.; FAVORETO, L.; CALANDRELLI, A.; SILVA, M. C. M. da. Reação de cultivares de soja ao nematoide Aphelenchoides besseyi. In: CONGRESSO BRASILEIRO DE FITOPATOLOGIA, 50., 2017, Uberlândia. Do manejo à edição do genoma: resumos. Brasília, DF: SBF, 2017a. 1 pendrive.
MEYER, M. C.; FAVORETO, L.; KLEPKER, D.; MARCELINO-GUIMARÃES, F. C. Soybean green stem and foliar retention syndrome caused by Aphelenchoides besseyi. Tropical Plant Pathology, v. 42, n. 5, p. 403-409, 2017b. DOI: https://doi.org/ 10.1007/s40858 017-0167-z.
MEYER, M. C.; KLEPKER, D. Efeito do manejo de solo e sistemas de cultivo na incidência de Soja Louca II. In: CONGRESSO BRASILEIRO DE FITOPATOLOGIA, 48.; CONGRESSO BRASILEIRO DE PATOLOGIA PÓS COLHEITA, 2., 2015, São Pedro. Fitopatologia de Precisão – Fronteiras da Ciência: Anais. Botucatu: SBF, 2015. 1 CD-ROM.
Fonte: Embrapa






