Fonte: Embrapa, Documentos 243.
Autores: Maria José Vilaça de Vasconcelos1, Andréa Almeida Carneiro2, José Edson Fontes Figueiredo3
Introdução
A modificação das características de uma planta através da manipulação do seu material genético via transgenia pode ser considerada um grande marco da biotecnologia do final do século XX. Plantas transgênicas possuem integradas no seu genoma combinações artificiais de genes provenientes de diferentes organismos (bactérias, vírus, plantas, etc.) que conferem tolerância a herbicidas, estresses bióticos e abióticos, além de expressarem proteínas capazes de modificar vias metabólicas agregando valor nutricional, entre outras características. Não obstante a finalidade dessas plantas seja beneficiar o meio ambiente, o agronegócio e os consumidores, elas geram grande controvérsia relacionada à sua segurança, uma vez que o processo de transgenia não acontece normalmente na natureza. O sucesso de uma tecnologia depende primordialmente da sua aceitação pelo público-alvo e, com relação às culturas transgênicas, surgiram preocupações éticas e percepções de risco principalmente porque a maioria dos transgênicos, aprovados para comercialização, contém elementos genéticos derivados de espécies sexualmente incompatíveis (ROMMENS, 2005).
Estas preocupações com a segurança ocasionam limitações de produção e comercialização destas plantas, principalmente pelos altos custos de uma desregulamentação do transgênico a nível mundial (Clive, 2012). Visando tornar esta importante tecnologia de transferência gênica mais aceitável pela opinião pública; reduzir a probabilidade de risco das plantas geradas e, consequentemente, diminuir os custos relacionados à biossegurança, novos processos de transformação denominados cisgenia e intragenia foram desenvolvidos como alternativas para a transgenia (Figura 1). Plantas cisgênicas e intragênicas são produzidas da mesma maneira que as plantas transgênicas, contudo apenas genes da mesma espécie ou espécies sexualmente compatíveis são utilizados, sendo as plantas resultantes destes processos semelhantes às plantas obtidas pelo melhoramento vegetal convencional (Schouten et al., 2006; Pavone; Martinelli, 2015). O objetivo deste documento é esclarecer as diferenças existentes entre os processos de modificações genéticas conhecidas como transgenia, cisgenia e intragenia e suas implicações para a biossegurança.
Transgenia: É a transferência de material genético entre espécies que não hibridizam naturalmente. Esta metodologia de melhoramento de plantas foi possível em razão do desenvolvimento da biologia molecular, que permitiu um grande avanço na identificação, caracterização, isolamento e transferência de genes entre espécies diferentes. Neste processo, os transgenes são inseridos na planta de interesse, utilizando, principalmente, transformação genética mediada por Agrobacterium tumefaciens ou bombardeamento de partículas. Em linhas gerais um transgene é constituído de regiões codificadoras do gene de interesse (GDI), do gene de seleção (GDS) e regiões regulatórias (promotores, terminadores, etc.) que controlam a expressão dos GDI e GDS (Carneiro et al., 2009). Em um transgene, estas regiões podem ser provenientes de qualquer organismo procarioto, eucarioto ou vírus, pois o DNA que codifica as proteínas de todos os organismos tem estrutura semelhante, podem ser intercambiado e continuar funcionando normalmente. Resumidamente, os transgenes são genes quiméricos em que promotores, terminadores e regiões codificadoras são provenientes de diferentes organismos.
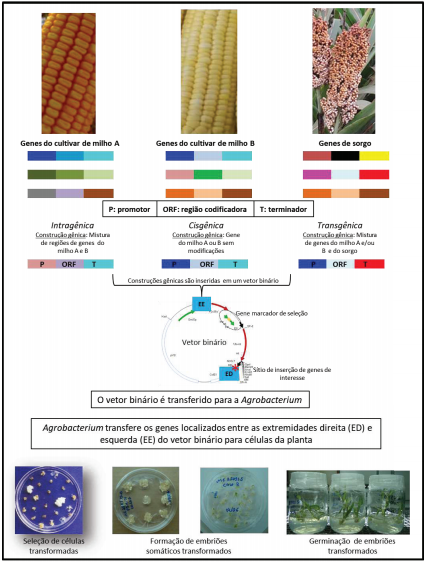 Figura 1.Transformação genética de plantas utilizando os conceitos de intragenia, cisgenia e transgenia.
Figura 1.Transformação genética de plantas utilizando os conceitos de intragenia, cisgenia e transgenia.
Modificações genéticas via transgenia têm o potencial de alterar a segurança das plantas, do meio ambiente e a segurança alimentar. Portanto, cultivares transgênicas são submetidas à minuciosa avaliação de segurança que utiliza uma abordagem metódica, gradual e holística. Torna-se essencial avaliar os riscos potenciais utilizando uma série de testes que incluem pesquisas de literatura, toxicologia (in vitro, in vivo e in silico), caracterização molecular, estimativa dos níveis de expressão e exposição às proteínas, ensaios de campo, estudos de alimentação animal e avaliação nutricional, dentre outros (Cockburn, 2002). Nestas avaliações de biossegurança, uma consideração exaustiva é dada à história de uso seguro do parental não transgênico, bem como dos doadores dos genes. Isso permite uma abordagem comparativa para reconhecer as semelhanças e diferenças entre a planta transgênica e seu comparador (parental) não transgênico. Além disso, faz-se uma avaliação sistemática, do ponto de vista da segurança, de quaisquer diferenças que possam ser identificadas entre o transgene e o parental.
O objetivo da avaliação de segurança de plantas transgênicas é demonstrar que a nova cultivar é tão segura quanto sua contraparte tradicional e, como tal, não traz riscos para a saúde humana, animal ou para o meio ambiente. Além disso, outro importante objetivo da avaliação de biossegurança é auxiliar os profissionais responsáveis ou reguladores nas suas decisões de liberar ou não para comercialização uma cultivar transgênica. No Brasil, o órgão do governo que controla a segurança de qualquer produto transgênico liberado comercialmente é a Comissão Técnica Nacional de Biossegurança – CTNBio. A CTNBio é constituída por especialistas das áreas de saúde humana, animal, vegetal, meio ambiente, biotecnologia, agricultura familiar, defesa do consumidor e representantes dos diversos ministérios. A função fundamental desta Comissão é assessorar o Governo Federal na formulação, atualização e implementação da Política Nacional de Biossegurança relativa à OGM, bem como no estabelecimento de normas técnicas de segurança e pareceres técnicos referentes à proteção da saúde humana, dos organismos vivos e do meio ambiente, para atividades que envolvam construção, experimentação, cultivo, manipulação, transporte, comercialização, consumo, armazenamento, liberação e descarte de OGM e derivados.
Cisgenia: É a transferência de material genético apenas entre espécies sexualmente compatíveis (Hunter, 2014). Este processo de transferência gênica é feito utilizando as mesmas técnicas usadas na produção de uma planta transgênica, entretanto, diferentemente da transgenia, são transferidos apenas cisgenes (cis = doador e receptor dos genes são espécies sexualmente compatíveis) e nunca transgenes (trans = doador e receptor podem ser espécies não compatíveis sexualmente) (Jochemsen; Schouten, 2000). Além disso, os genes transferidos (regiões codantes e regulatórias) são exatamente iguais aos presentes na espécie de origem e não existe nenhum DNA proveniente de organismos heterólogos.
Na cisgenia, genes heterólogos, incluindo os genes do vetor e os marcadores de seleção, não são encontrados no produto final (Espinoza et al., 2013). Em uma planta cisgênica pode ser introduzida uma ou mais cópias do cisgene de interesse para aumentar a expressão de um gene (Shiva et al., 2013). A cisgenia é similar ao melhoramento genético convencional, mas com maior exatidão, pois nesta técnica ocorre a transferência apenas do gene de interesse sem qualquer problema potencial de transferência de genes deletérios ou indesejáveis, como ocorre no melhoramento convencional de plantas (Delwaide, 2014). Além disso, a cisgenia acelera o processo de melhoramento convencional, pois evita todas as etapas existentes para a eliminação das características fenotípicas não desejáveis (Rommens et al., 2007). A Tabela 1 mostra alguns exemplos de plantas transformadas utilizando o processo de cisgenia.
Tabela 1. Exemplos de plantas modificadas geneticamente utilizando cisgenes ou intragenese.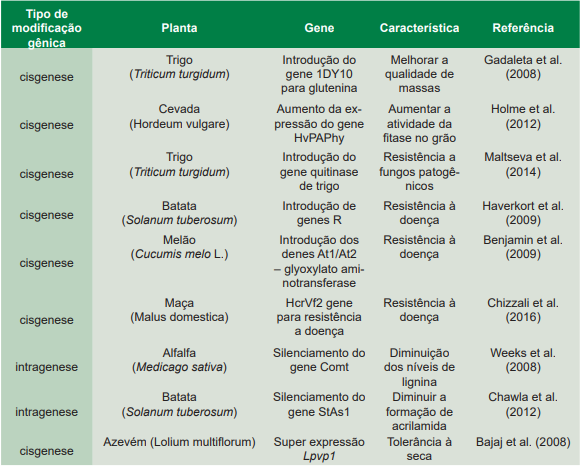
Em termos de biossegurança, uma das principais preocupações relacionadas às plantas transgênicas é a produção de uma nova proteína e seus possíveis efeitos nos organismos consumidores. Essa preocupação não é real quando a abordagem cisgênica é utilizada, uma vez que os genes transferidos são da mesma espécie ou de uma espécie sexualmente compatível. Portanto, não há produção de uma nova proteína na planta receptora e, consequentemente, as análises de risco podem ser menos rigorosas do que as realizadas para verificação da segurança das plantas transgênicas (Podevin et al., 2012). No entanto, existem algumas diferenças entre os produtos finais obtidos por cisgenia e melhoramento convencional. O cisgene está presente na planta transformada como uma cópia extra no genoma, o que poderá resultar em níveis alterados de expressão do gene-alvo. Além disso, a integração do cisgene na planta receptora é aleatória, podendo levar à mutagênese do gene no qual o cisgene se integrou (Schouten et al., 2006). Estas diferenças devem ser analisadas, usando como comparação o parental não cisgênico para se atestar a segurança da planta cisgênica.
Intragenia: A intragenia pode ser definida como a utilização de elementos genéticos específicos de uma planta, recombinação desses elementos in vitro e inserção dos cassetes de expressão resultantes em uma planta pertencente ao mesmo grupo de compatibilidade sexual (Rommens et al., 2004). Os métodos de transferência gênica são os mesmos utilizados para a transgenia ou cisgenia. Similar à cisgenia, os genes e as regiões regulatórias utilizadas na construção gênica pertencem à mesma espécie ou espécies sexualmente compatíveis. Entretanto, regiões codantes e regulatórias podem ser organizadas de maneira diferente da encontrada no genoma original, formando um gene híbrido. O silenciamento de genes utilizando a técnica de RNA de interferência (RNAi), que introduz repetições invertidas de DNA da planta receptora, também é considerado um intragene. A intragenia é menos restritiva que a cisgenia e oferece consideravelmente maiores opções para modificar a expressão do gene ao permitir combinações entre eles. Em oposição à cisgenia, o fenótipo resultante da intragenia não pode ser obtido pelos métodos convencionais de melhoramento genético de plantas, uma vez que os genes inseridos são novas combinações de elementos genéticos funcionais possuindo a mesma origem da planta nativa.
Confira nossa galeria de cursos TOTALMENTE ONLINE! Agregue conhecimento, faça já!
A expressão do intragene é diferente da expressão do gene nativo (Devi et al., 2013). A Tabela 1 mostra alguns exemplos de plantas transformadas utilizando o processo de intragenia. Com relação à biossegurança de plantas produzidas utilizando o conceito da intragênese, existe o fato de que nesse procedimento emprega-se construção de genes quiméricos que não existem na natureza. Esses novos genes podem apresentar níveis e padrões de expressão diferentes dos genes parentais. Similar às plantas cisgênicas, a integração do intragene é aleatória, o que pode gerar mutações gênicas na planta receptora. As proteínas produzidas na cultivar intragênica já estão naturalmente presentes no parental não modificado geneticamente, entretanto podem ter um nível de expressão e localização tecidual diferente. As consequências para a segurança humana, animal e ambiental desse novo produto devem ser avaliadas em um estudo caso a caso e comparadas ao parental não modificado.
Referências
BAJAJ, S.; PUTHIGAE, S.; TEMPLETON, K.; BRYANT, C.; GILL, G.; LOMBA, P.; ZHANG, H.; ALTPETER, F.; HANLEY, Z. Towards engineering drought tolerance in perennial ryegrass using its own genome. In: CANADIAN PLANT GENOMICS WORKSHOP, 6., 2008, Toronto. Abstracts… Toronto: [s.n.], 2008. p. 62.
BENJAMIN, I.; KENIGSBUCH, D.; GALPERIN, M.; ABRAMETO, J. A.; COHEN, Y. Cisgenic melons over expressing glyoxylate-aminotransferase are resistant to downy mildew. European Journal of Plant Pathology, v. 125, n. 6, p. 355-365, 2009.
CARNEIRO, A. A.; GUIMARÃES, C. T.; VALICENTE, F. H.; WAQUIL, J. M.; VASCONCELOS, M. J. V.; CARNEIRO, N. P.; MENDES, S. M. Milho Bt: teoria e prática da produção de plantas transgênicas resistentes a insetos-praga. Sete Lagoas: Embrapa Milho e Sorgo, 2009. 25 p. (Embrapa Milho e Sorgo. Circular Técnica, 135).
CHAWLA, R.; SHAKYA, R.; ROMMENS, C. M. Tuber-specific silencing of asparagine synthetase-1 reduces the acrylamide-forming potential of potatoes grown in the field without affecting tuber shape and yield. Plant Biotechnology Journal, v. 10, n. 8, p. 913-924, 2012.
CHIZZALI, C.; GUSBERTI, M.; SCHOUTEN, H. J.; GESSLER, C.; BROGGINI, G. A. L. Cisgenic Rvi6 scab- resistant apple lines show no differences in Rvi6 transcription when compared with conventionally bred cultivars. Planta, v. 243, n. 3, p. 635-644, 2016.
CLIVE, J. Global status of commercialized biotech/GM crops. Ithaca: ISAAA, 2012. (ISAAA.
Brief nº 44).
COCKBURN, A. Assuring the safety of genetically modified (GM) foods: the importance of an holistic, integrative approach. Journal of Biotechnology, v. 98, n. 1, p. 79-106, 2002.
DELWAIDE, A. C. European consumer’s attitudes towards cisgenic rice. Dissertação (Mestrado em Economia Agrícola) – University of Arkansas, Fayetteville, 2014.
DEVI, E. L.; CHONGTHAM, S. K.; HOLEYACHI, P.; KOUSAR, N.; SINGH, M.; BEHERA, C.; SINGH, N. B.; WANI, S. H. Cisgenesis and intragenesis: twin sisters for crop improvement. Research Journal of Agriculture and Forestry Sciences, v. 1, p. 22-26, 2013.
ESPINOZA, C.; SCHLECHTER, R.; HERRERA, D.; TORRES, E.; SERRANO, A.; MEDINA, C.; ARCE-JOHNSON, P. Cisgenesis and intragenesis: new tools for improving crops. Biological Research, v. 46, n. 4, p. 323-331, 2013.
GADALETA, A.; GIANCASPRO, A.; BLECHL, A. E.; BLANCO, A. A transgenic durum wheat line that is free of marker genes and expresses 1Dy10. Journal of Cereal Science, v. 48, n. 2, p. 439-445, 2008.
HAVERKORT, A. J.; STRUIK, P. C.; VISSER, R. G. F.; JACOBSEN, E. Applied biotechnology to
combat late blight in potato caused by Phytophthora infestans. Potato Research, v. 52, n. 3, p. 249-264, 2009.
HOLME, I. B.; DIONISIO, G.; BRINCH-PEDERSEN, H.; WENDT, T.; MADSEN, C. K.; VINCZE, E.; HOLM, P. B. Cisgenic barley with improved phytase activity. Plant Biotechnology Journal, v. 10, n. 2, p. 237-247, 2012.
HUNTER, P. “Genetically modified Lite” placates public but not activists. EMBO Reports, v. 15, n. 2, p. 138-141, 2014.
JOCHEMSEN, H.; SCHOUTEN, H. J. Ethische beoordeling van genetische modificatie. In: JOCHEMSEN, H. (Ed.). ‘Toetsen en Begrenzen: een ethische en politieke beoordeling van de
moderne biotechnologie’. Amsterdam: Buijten and Schipperheijn, 2000. p. 88-95.
MALTSEVA, E.; ISMAGUL, A.; ISKAKOVA, G.; CHIRKIN, A.; SKIBA, Y.; ISMAGULOVA, G.; ELIBY, S.; AITKHOZHINA, N. Wheat cisgenic transformation with class I chitinase gene. Journal of Biotechnology, v. 185, p. S116-S117, 2014.
PAVONE, V.; MARTINELLI, L. Cisgenics as emerging bio-objects: bio-objectification and bioidentification in agrobiotech innovation. New Genetics and Society, v. 34, n. 1, p. 52-71, 2015.
PODEVIN, N.; DEVOS, Y.; DAVIES, H. V.; NIELSEN, K. M. Transgenic or not? No simple answer! New biotechnology-based plant breeding techniques and the regulatory landscape. EMBO Reports, v. 13, n. 12, p. 1057-1061, 2012.
PURCHASE, I. What determines the acceptability of genetically modified food that can improve human nutrition? Toxicology and Applied Pharmacology, v. 207, n. 2, p. 19-27, 2005.
ROMMENS, C. M.; HARING, M. A.; SWORDS, K.; DAVIES, H. The intragenic approach as a new extension to traditional plant breeding. Trends Plant Science, v. 12, n. 9, p. 397-403, 2007.
ROMMENS, C. M.; HUMARA, J. M.; YE, J.; YAN, H. Crop improvement through modification of the plant’s own genome. Plant Physiology, v. 135, p. 421-431, 2004.
SCHOUTEN, H. J.; KRENS, F. A.; JACOBSEN, E. Cisgenic plants are similar to traditionally bred plants. EMBO Reports, v. 7, n. 8, p. 750-753, 2006.
SHIVA, P. G.; RAJU, B.; RAJESH KUMAR, K. Cisgenesis: an alternate approach for development of genetically modifi ed crops. Annals of Biological Research, v. 4, n. 9, p. 109-115, 2013.
WEEKS, J. T.; YE, J.; ROMMENS, C. M. Development of an in-planta method for transformation of alfalfa (Medicago sativa). Transgenic Research, v. 17, n. 4, p. 587-597, 2008.
Informações dos autores
1Farmacêutica/Bioquímica, PhD Pesquisadora Embrapa Milho e Sorgo;
2Bióloga, PhD Pesquisadora Embrapa Milho e Sorgo;
3Biólogo, PhD Pesquisador da Embrapa Milho e Sorgo.
Fonte: Embrapa Milho e Sorgo. Documentos 243. Dezembro/2019. ISSN 1518-4277




