A mosca-branca, Bemisia tabaci (Figura 1) é um inseto sugador pertencente à ordem Hemiptera, que inclui percevejos e cigarrinhas. Existem mais de 30 espécies de mosca-branca, morfologicamente indistinguíveis entre si e que eram anteriormente denominadas “biótipos”. Atualmente disseminada por 165 países, a mosca-branca apresenta a maior distribuição global dentre todos os insetos-praga, além de apresentar resistência a 56 inseticidas diferentes e transmitir mais de 100 vírus fitopatogênicos (WILLIS, 2017).
Figura 1. Adulto (esquerda) e ninfa (direita) de B. tabaci em folha de soja
Fonte: ARNEMANN et al. (2019). Confira a imagem original clicando aqui
A espécie B. tabaci MEAM1 (anteriormente chamada de “Biótipo B”), introduzida no Brasil na década de 90, é a que causa danos mais severos na cultura da soja. Seu potencial médio de redução de produtividade é de 22% (VIEIRA et al., 2013). Segundo Padilha et al. (2020), isso representa uma perda de até 35 kg ha-1 no rendimento de grãos, se cada trifólio das plantas de soja apresentar pelo menos uma mosca-branca (ninfa ou adulto).
Para compreendermos a dinâmica do dano de mosca-branca em soja e definirmos estratégias de manejo, é necessário entender como a praga coloniza as plantas de soja. As fêmeas de B. tabaci alimentam-se e depositam seus ovos no terço superior das plantas (CZEPAK et al., 2018), devido às maiores concentrações de açúcares presentes nas folhas mais jovens. À medida que as plantas crescem, as folhas que anteriormente compunham o terço superior passam a compor o terço médio, juntamente com os ovos ali depositados e as ninfas recém-eclodidas (POZEBON et al., 2019). Assim, a maior concentração de ninfas de mosca-branca é encontrada geralmente no terço médio das plantas de soja, com predominância do 1º e 2º ínstares (Figura 2).
Figura 2. Número médio de ninfas de B. tabaci por área foliar, nos terços superior, médio e inferior das plantas de soja.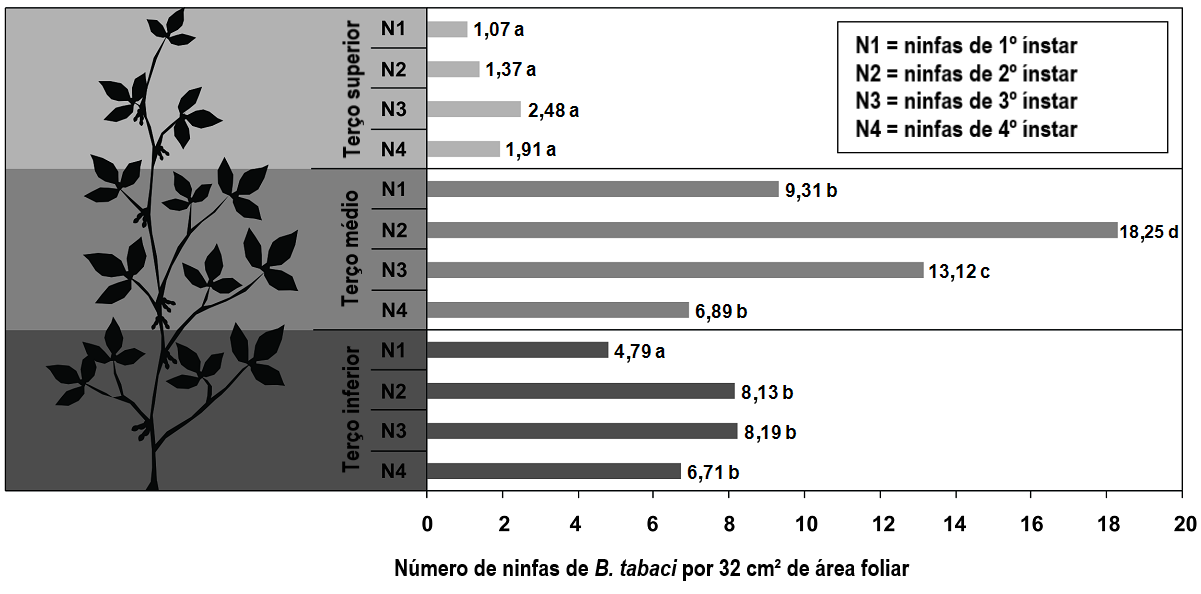
Fonte: POZEBON et al. (2019). Confira a imagem original clicando aqui.
Já as ninfas de ínstares mais avançados (3º e 4º) são predominantemente encontradas no terço inferior das plantas de soja. Da mesma forma, as folhas do terço inferior apresentam o maior número de exúvias, que são as cutículas mortas deixadas pelos adultos de mosca-branca após abandonarem a forma de ninfa. As exúvias são facilmente identificáveis pela presença de uma abertura em forma de T, por onde o inseto adulto emergiu (Figura 3). A presença de um elevado número de exúvias indica que a maior parte do dano já foi infringida à planta, e que os adultos de mosca-branca abandonaram-na para colonizar outras plantas.
Figura 3. Exúvia de B. tabaci após emergência da forma adulta
Foto: Grupo de Manejo e Genética de Pragas – UFSM
Além da distribuição ao longo do perfil das plantas, também existe um padrão na distribuição das ninfas de B. tabaci em cada folíolo de soja. As maiores concentrações de ninfas são geralmente encontradas na região basal dos folíolos, próximo à inserção do pecíolo (Figura 4). Esse padrão é mais recorrente em folíolos do terço médio das plantas de soja e pode ser explicado pela maior circulação de seiva nessa parte do limbo foliar, favorecendo a alimentação das ninfas de mosca-branca (POZEBON et al., 2019).
Figura 4. Número médio de ninfas de B. tabaci por cm², na face inferior de folíolos de soja.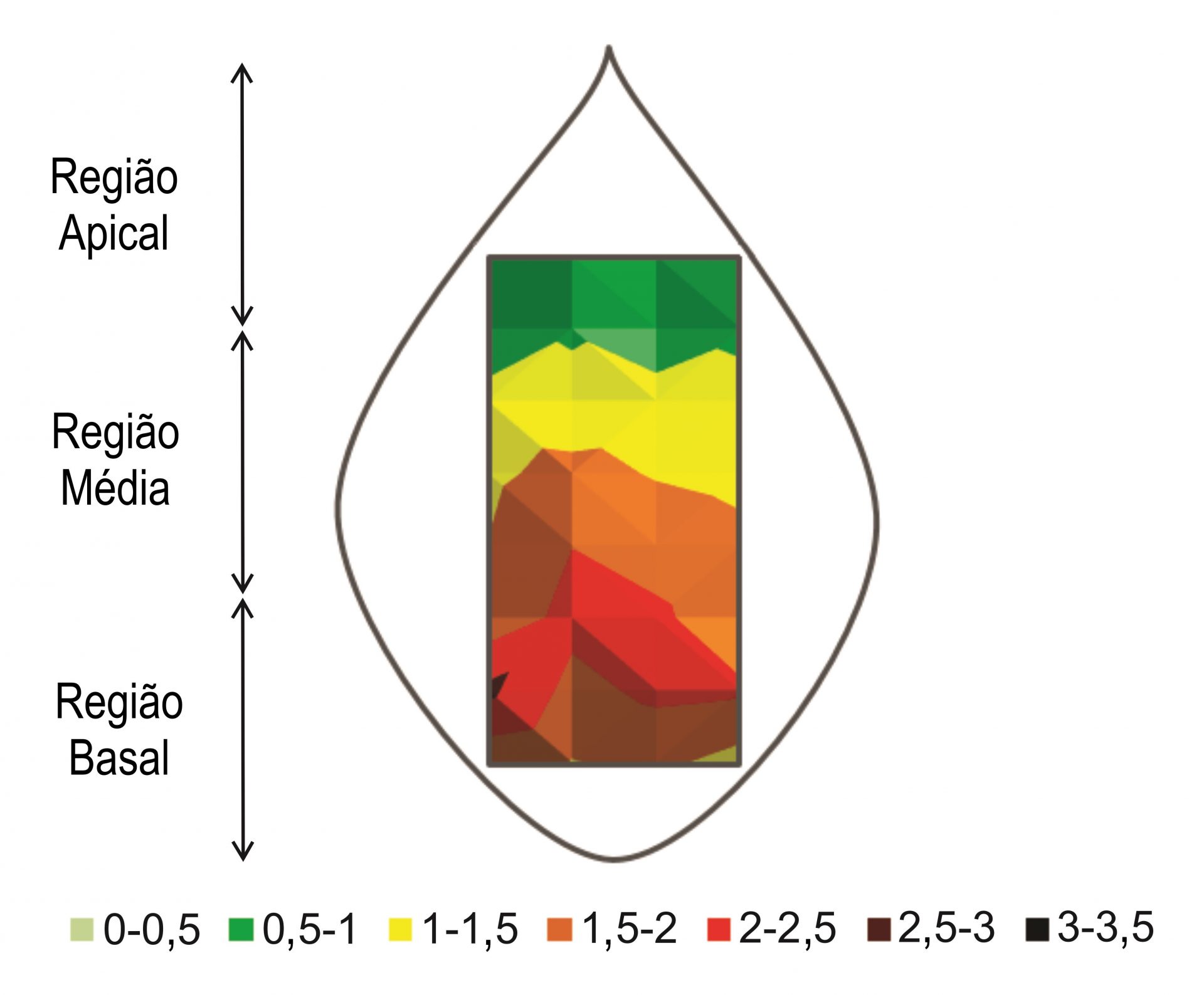
Fonte: POZEBON et al. (2019). Confira a imagem original clicando aqui
Com base nessas informações, é possível aperfeiçoar os planos de amostragem para mosca-branca em soja, monitorando adultos no terço superior e ninfas nos terços médio e inferior das plantas. Destaca-se ainda que todas as fases de B. tabaci (ninfas e adultos) são encontradas na face inferior das folhas, que devem ser viradas cuidadosamente durante a amostragem para evitar que os adultos voem.
Quanto às estratégias de manejo, os adultos de mosca-branca (mais expostos, no terço superior) são mais facilmente controlados do que as ninfas (mais protegidas, nos terços médio e inferior). Assim, é essencial que o inseticida aplicado atinja todos os terços do dossel da soja, elevando a eficiência de controle e evitando re-infestações. Considerando que a mosca-branca geralmente atinge seu pico populacional durante o florescimento das plantas de soja (R1), deve-se reforçar o monitoramente nesse período. Aplicações em estágios posteriores dificilmente atingirão os terços médio e inferior das plantas, devido ao alto índice de área foliar.
Ademais, os inseticidas com maior efeito de controle sobre mosca-branca em soja pertencem ao grupo químico dos neonicotinóides (imidacloprido, acetamiprido e tiametoxam, entre outros), que possuem ação sistêmica nas plantas. Entretanto, essa translocação ocorre apenas em um sentido: das folhas mais velhas para as mais jovens, ou seja, de baixo para cima (via xilema; BUCHHOLZ; NAUEN, 2002). Portanto, a distribuição do inseticida aplicado ao longo do dossel com uma boa cobertura de gotas é fundamental, possibilitando que o ingrediente ativo penetre nas folhas do terço inferior e seja translocado até as folhas do terço médio, onde a maior parte das ninfas de mosca-branca está localizada.
 Revisão: Prof. Jonas Arnemann, PhD. e coordenador do Grupo de Manejo e Genética de Pragas – UFSM
Revisão: Prof. Jonas Arnemann, PhD. e coordenador do Grupo de Manejo e Genética de Pragas – UFSM

REFERÊNCIAS:
BUCHHOLZ, A.; NAUEN, R. Translocation and translaminar bioavailability of two neonicotinoid insecticides after foliar application to cabbage and cotton. Pest Management Science 58: 10–16, 2002.
CZEPAK, C. et al. Bemisia tabaci MEAM1 population surveys in soybean cultivation. Entomologia Experimentalis et Applicata 166: 215–223, 2018. Disponível em: https://onlinelibrary.wiley.com/doi/full/10.1111/eea.12656
PADILHA, G. et al. Damage assessment of Bemisia tabaci and economic injury level on soybean. Crop Protection, 2020. Artigo em trâmite para publicação.
POZEBON, H. et al. Distribution of Bemisia tabaci within soybean plants and on individual leaflets. Entomologia Experimentalis et Applicata 167: 396–405, 2019. Disponível em: https://onlinelibrary.wiley.com/doi/abs/10.1111/eea.12798
VIEIRA, S. S. et al. Different timing of whitefly control and soybean yield. Ciência
Rural, Santa Maria, v. 43, p. 247-253, 2013.
WILLIS, K. J. State of the World’s Plants. Kew, Royal Botanic Gardens, 96 p.,
2017. Disponível em: https://issuu.com/fernandoruz/docs/sotwp_2017



