O período crítico na cultura do algodão para incidência de B. tabaci está relacionado desde a emergência das plantas até o aparecimento dos primeiros capulhos (ARAÚJO et al., 1999). O algodão é ameaçado por diversas pragas durante seu ciclo. Os consumos de inseticidas podem chegar a 25% do total das pulverizações da cultura do algodão (BULL & HATHAWAY, 1986).
Os fatores responsáveis pela incidência de mosca-branca na cultura são (BROWN et al., 1989):
- Hábito polífago;
- Capacidade de transmitir viroses;
- Eliminação de seus inimigos naturais;
- Movimentação constante entre as áreas cultivadas;
- Resistência pelo uso indiscriminado de alguns mecanismos de ação.
Estas pragas causam no algodão diversos prejuízos pela produção de fumagina nas hastes e nos capulhos. Alguns estados, principalmente na região nordeste, estimaram perdas de rendimento entre 30-80%, e em situações mais graves, perda total da produção (BLEICHER & MELO, 1998).
Ciclo de Desenvolvimento
Os adultos possuem cerca de 2 mm de comprimento e podem ser vistos na lavoura. Geralmente estão presentes no terço superior e mediano da planta, situando-se na parte inferior das folhas. (EMBRAPA, 2000).
Figura 1. Adulto de B. tabaci na parte abaxial das folhas do algodão.

Os ovos são de cor amarela e, perto da eclosão escurecem. As ninfas são translúcidas e permanecem na parte abaxial das folhas. As de 1° instar se locomovem até acharem o local para introduzir o estilete. Ninfas de 2°, 3° e 4° instares, são imóveis.
Figura 2. Ninfas pertencentes a diversos instares de B. tabaci

Danos
As pragas podem ocasionar tanto danos diretos quanto indiretos nas culturas hospedeiras. Pertencente à ordem Hemiptera, como outros insetos sugadores. Os danos diretos estão relacionados com a sucção da seiva pelos adultos e pelas ninfas. O inseto, ao se alimentar, injeta toxinas que podem causar anomalias no desenvolvimento da planta, como pontuações necróticas, encrespamento, murcha e envelhecimento precoce das folhas (INSTITUTO MATO-GROSSENSE DO ALGODÃO, 2016).
Além disso, excreta um melado chamado “Honeydew” que serve para o desenvolvimento de fungos do gênero Capnodium. Esse organismo formará uma camada escura na parte superior das folhas do algodão, chamado fumagina. Com as folhas escuras, reduz-se a produção de fotossíntese e, consequente, acarreta queda de produtividade (EMBRAPA, 2000).
Figura 3. Folha exibindo sintomas de fumagina, com presença significativa de ninfas.

Na cultura do algodão, o melado compromete as estruturas das fibras, pois faz com que se tornem pegajosas. O resultado é redução do valor da fibra (BRUSHWOOD & PERKINS, 1994). As excreções açucaradas atingem as fibras e recobrem a estrutura, fenômeno chamado de “fibra açucarada”.
A seiva sobre os capulhos prejudica a indústria, pois dificulta a extração das fibras, danifica as máquinas durante o processamento, altera a qualidade da fibra e diminui a lucratividade (HEQUET & ABIDI, 2002).
Figura 4. Fibra contaminada pela fumagina.

Os danos indiretos estão relacionados com a transmissão de vírus. As variedades suscetíveis podem apresentar perdas de 100% (SERRANO et al., 1993). As plantas infectadas pelo vírus “mosaico comum”, apresentam como sintomas um mosaico amarelo, redução da área foliar e queda de flores e frutos (INTERNATIONAL COTTON ADVISORY COMMITTEE, 1997). As reduções de produção causadas por essa virose podem ocasionar perdas de 50% (SILVEIRA, 1965). Relata-se que 90 viroses são transmitidas pela mosca-branca. Entre elas, destaca-se o mosaico do algodoeiro.
Figura 5. Planta de algodoeiro com sintomas de mosaico comum, transmitido pela mosca-branca.

Monitoramento:
Para Adultos (metodologia do Arizona, EUA)
Apesar das condições de voo dos insetos dificultarem a precisão da densidade populacional da praga, a amostragem baseada na presença ou na ausência do inseto, é a mais eficaz para indicar o nível de controle (EMBRAPA, 2000). A amostragem deve ser realizada a cada 1 semana. 50 amostras devem ser coletadas até as 9 horas da manhã, quando os insetos estão menos ativos.
Adentre em torno de 10 linhas no campo (contadas a partir da bordadura), escolhendo as plantas aleatoriamente para contar o número de adultos. Escolhe-se as plantas e se vira cuidadosamente o folíolo do terço superior da planta, pois estão situados na parte abaxial das folhas. Anote em uma planilha as folhas que foram atacadas quando apresentarem 3 adultos ou mais em cada folíolo das 50 amostras. Faça a avaliação em ziguezague na área, de modo a atingir todo o talhão.
Para Ninfas (metodologia de DIEHL et al., 1997)
Leve para a lavoura uma lupa que cubra 4 cm2 do folíolo. Retire uma folha do terço médio e conte na parte abaxial o número de ninfas encontradas do 3° e 4° instar. As grandes possuem o tamanho maior e manchas amareladas no corpo. Além disso, ninfas de 4° instar possuem dois olhos vermelhos. Anote na planilha como folha atacada se for encontrada 1 ou mais ninfas grandes (3° e 4° instares).
Figura 6. Diagrama de uma folha de algodoeiro indicando a parte abaxial das folhas para contagem.

Deve-se contabilizar os adultos inicialmente, visto que possuem capacidade de voo.
Nível de Ação
Aplicar os inseticidas somente quando atingir o nível de controle de 40% para ninfas e 60% para adultos das 50 amostras coletadas a campo. Se atingir o nível de controle com menos de 50 amostras, deve-se realizar as aplicações.
Manejos
- Controle Cultural
- Irrigar as plantas pois o estresse por água aumenta a incidência da praga;
- Eliminação de plantas daninhas que possam hospedar a praga;
- Remover e destruir plantas infectadas por vírus;
- Destruir os restos culturais logo após a colheita para evitar a sobrevivência da praga na lavoura;
- Realizar rotação de cultura com milho ou outra gramínea;
- Instalar barreiras vegetais como milho ou sorgo, mantendo 10 metros de distância da periferia da área cultivada.
- Controle Biológico
O controle biológico é uma técnica eficaz no combate à mosca-branca. Os fungos de Beauveria bassiana são caracterizados por um controle microbiológico que atua em Bemisia tanto na fase de pupa quanto adulto, infectando através do tegumento.
O fungo contamina a praga em até 72 horas, podendo levar a morte. Os insetos atacados apresentam micélio branco que esporula em condições de temperatura de 23 a 30ºC e umidade relativa acima de 60% (KOPPERT).
Figura 7. Ação do inseticida à base de B. bassiana PL 63 sobre ninfas e adultos de mosca-branca.
Aplicações ocorrem na forma líquida a partir de pulverizações convencionais. Realiza-se 2 aplicações com volume de calda variando de 150-250 L.ha-1. Pode-se utilizar entre 0,5 – 1 Kg.ha-1 (KOPPERT).
- Controle Químico
Não devem ser utilizados piretroides antes dos 70 dias de emergência da cultura para evitar a mortalidade dos inimigos naturais (EMBRAPA, 2000). Os inseticidas utilizados para controle de Bemisia tabaci, segundo AGROFIT (2020), pertencem aos grupos químicos das sulfoxaminas, organofosforado, neonicotinoide e éter piridiloxipropílico.
Já para o controle de Bemisia tabaci biótipo B, os grupos químicos que estão registrados para controle são: neonicotinoide, éter piridiloxipropílico, feniltioureia, tiadiazinona, piridina azometina, antranilamida, piretroide e cetoenol. Características que diferencia o biótipo B dos outros é a formação de desordens fisiológicas nas plantas infestadas. Os reguladores de crescimento afetam diretamente as ninfas.
Há relatos de resistência a diversos grupos químicos, como piretroides, organofosforados, carbamatos, neonicotinoides e inseticidas reguladores de crescimento como buprofezina e piriproxifem. Segundo estudos da ESALQ, há casos de elevada resistência para o grupo químico dos neonicotinoides em controle de mosca-branca (IRAC).
Figura 8. Controle de Bemisia tabaci no algodoeiro.
O IMAmt realizou na safra 2015/16 experimentos com inseticidas químicos e microbiológicos para verificar a eficiência de controle de B. tabaci no algodão. As avaliações foram realizadas em cinco datas diferentes, sendo aos 2 e 5 dias após a primeira aplicação e aos 2, 5 e 10 dias após a segunda aplicação.
A contagem de ovos possibilita verificar o efeito dos inseticidas sobre adultos de B. tabaci. A contagem de ninfas visa verificar o efeito dos inseticidas sobre as próprias ninfas.
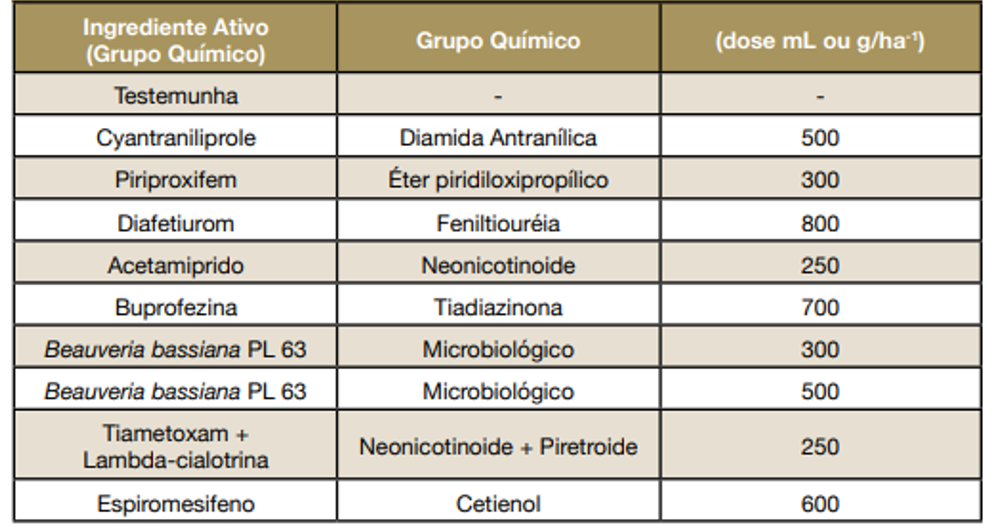
Tabela 1. Inseticidas utilizados para controle de Bemisia tabaci no algodão.
Tabela 2. Eficiência no controle (em porcentagem) de ovos de Bemisia tabaci aos 2 e 5 dias após a primeira aplicação e aos 2, 5 e 10 dias após a segunda aplicação. Rondonópolis, MT, safra 2015/2016.

Podemos observar que para controle químico, Buprofezina possui um bom desempenho de controle, entretanto, reduziu ao final da avaliação. Enquanto que Espiromesifeno aumentou a eficácia. Ambos apresentaram eficiência > 80%. Para controle biológico, B. bassiana PL 63 (500 g pc.ha-1), mostrou-se eficaz. Entretanto, não atingiu 80% de controle.
Tabela 3. Eficiência no controle (em porcentagem) de ninfas de Bemisia tabaci aos 2 e 5 dias após a primeira aplicação e aos 2, 5 e 10 dias após a segunda aplicação. Rondonópolis, MT, safra 2015/2016.
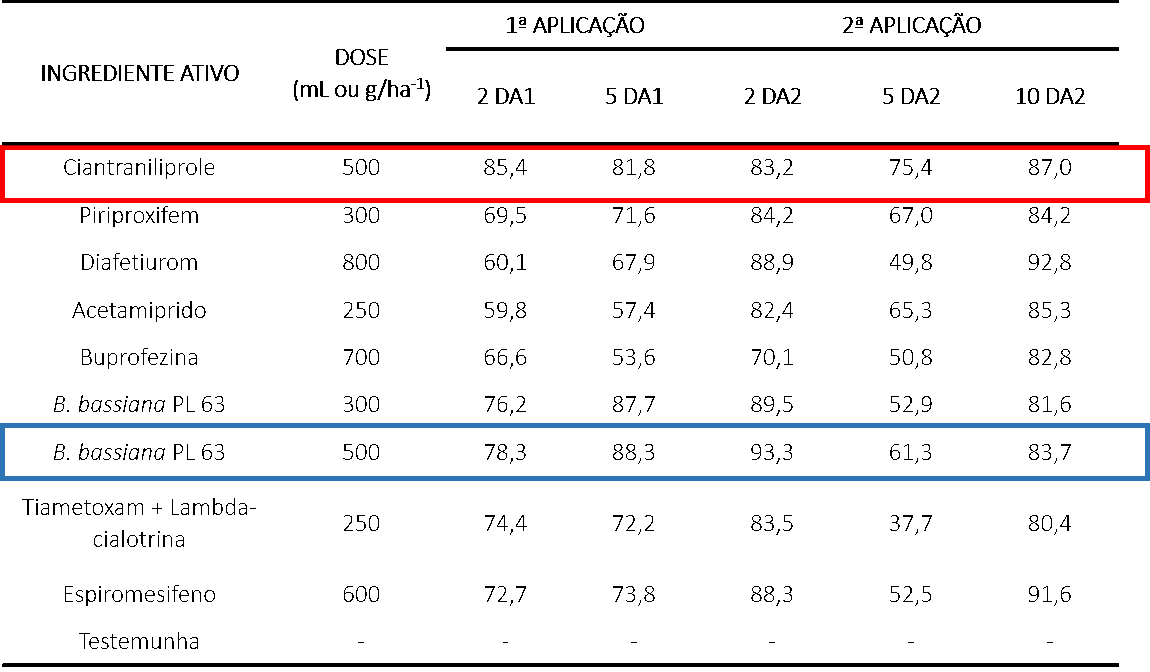
O efeito do controle foi maximizado após a segunda aplicação. 10 dias após a segunda aplicação, todos os produtos mostraram eficiência >80%. Assim, podemos notar a importância das aplicações sequenciais. Ciantraniliprole e B. bassiana PL 63 (500 g pc.ha-1), mostram grande eficiência no controle de ninfas.
As aplicações do inseticida microbiológico foram realizas em condições ambientais ideais, como pulverizações realizadas em condições de alta umidade relativa, ao final do dia e aliadas ao não uso de fungicidas.
Veja também: Algodão Bt – a tecnologia que controla pragas e beneficia o produtor
Considerações Finais
A mosca-branca (Bemisia tabaci) é uma praga hospedeira de diversas culturas de importância agrícola. A principal medida é realizar o monitoramento dos insetos-praga, a fim de realizar as aplicações no momento que atingir o limiar de ação para controle. Pode-se obter eficiência através dos inseticidas químicos e biológicos, como apresentamos no texto.
As medidas do MIP (Manejo Integrado de Pragas), devem ser seguidas para evitar maximizar os casos de resistência e obter a eficiência desejada do produto. Há diversos mecanismos de ação que podem ser manejados durante a safra.
Segue-se os esforços para desenvolver e implantar o MIP-Algodoeiro, que já tem promovido mudanças na agricultura. O apoio dos governos estaduais, federais e do setor privado devem continuar para permitir o maior desenvolvimento da cotonicultura.
REFERÊNCIAS
ARAUJO, L. H. A et al. Manejo de Mosca Branca Bemisia argentifolii Bellows & Perring no Algodoeiro. Circular Técnica, Embrapa, PB – 2000.
ARAUJO, L. H. A.; SANTOS, P. A de L; LIMA, M. G. A. de. Parasitismo de mosca branca por Encarsia lutea (Masi) (Hymenoptera:Aphelinidae) em algodoeiro. In: ENCONTRO LATINO AMERICANO E DO CARIBE SOBRE MOSCAS BRANCAS E GEMINIVÍRUS, 7., 1999, Recife. Anais… Recife: [s.n], 1999. p. 114.
BLEICHER, E.; MELO, Q. M. S. Manejo da mosca branca Bemisia argentifolii Bellows & Perring. Fortaleza: EMBRAPA-CNPAT, 1998. 15 p. (EMBRAPA-CNPAT, Circular Técnica, 3).
BROWN, J. K.; POZO-COMPODONICO, O.; NELSON, M. R. A whitefly-transmitted geminivirus from peppers with tigre disease. Plant disease, v. 73, p. 610, 1989.
BRUSHWOOD, D. E.; PERKINS, H. H. Characterization of sugarsfrom honeydew cotaminated and normal cottons, In: BELTWIDE COTTON PRODUCTION CONFERENCE, 1994, Memphis, Proceedings… Memphis: National Cotton Council of America, 1994. p. 1408-1411.
BULL, D.; HATHAWAY, D. Pragas e venenos: agrotóxicos no Brasil e no terceiro mundo. Petrópolis: Vozes, 1986. 235 p.
DIEHL, J.; ELLSWORTH, P.; NARANJO, S. Whiteflies in Arizona: Binomial sampling of nymphs Arizona: University of Arizona, 1997. 2 p. (Cooperative Extension, 11).
HEQUET, E.; ABIDI, N. High-speed stickiness detector measurement: effect of temperature settings and relative humidity. Journal of Cotton science., v. 6, n. 1, p. 68-76, 2002.
INSTITUTO MATO-GROSSENSE DE ALGODÃO. Efeito de inseticidas sobre o controle de mosca-branca na cultura do algodoeiro. Circular Técnica, número 25, 2016
INTERNATIONAL COTTON ADVISORY COMMITTEE. Common fund projects. Asunción, 1997. 52 p.
IRAC. RESISTÊNCIA DE MOSCA-BRANCA A INSETICIDAS. Disponível em: <https://www.irac-br.org/bemisia-tabaci>. Acesso em: 24.03.2020
KOPPERT. Boveril – Fungo entomopatogênico (Inseticida microbiológico). Disponível em: < https://www.koppert.com.br/boveril/>. Acesso em: 24.03.2020
SERRANO, L.; SERMENO, J. M.; LARIOS, J. F. Las moscas blancas en El Salvador. In: HILJE, L.; ARBOLEDA, O. Las moscas blancas (Homoptera: Aleyrodidae) en America Central y Caribe. Turrialba: CATIE, 1992, p. 42-49. (CATIE. Série Técnica, Informe Técnico, 205)
SILVEIRA, A. P. Moléstias-fungos e bactérias. In: INSTITUTO BRASILEIRO DE POTASSA, Cultura e adubação do algodoeiro. São Paulo: 1965. p. 417.
Redação: Equipe Mais Soja.