Este texto foi escrito para mostrar a importância da citação de Behe (1977) de que “a ciência sem números não tem valor ou não existe”. Se entende também, que na escrita científica deve ser evitado o uso de adjetivos. Além disso, Behe lembra também que “o que não se publica não foi feito ou não existe”!
A soja [Glycine max (L.) Merr. ] é uma planta adaptada às regiões onde a temperatura flutua entre 20ºC e 30ºC sendo a ideal ao seu desenvolvimento ao redor de 30oC (FAO, 1986) e com requerimentos hídricos para obter o máximo rendimento de grãos de 450 a 800 mm durante o seu ciclo (FAO, 1986; Farias t al., 2007);
Na área experimental do Instituto Agris, foi determinada a população de plantas: espaçamento de 0, 45 m entre linhas, 14 plantas/m, correspondendo a 31.2/m2 ou 312.000 plantas/ha. Numa amostra de 10 plantas determinou-se 62, 7 (39 – 108) folíolos/planta e 14, 2 (11 – 15) nós/haste. A área média dos folíolos foi de 75, 5 cm2 (62, 7 – 80, 7 cm2), totalizando 4.733,8 cm2/planta. Calcule o número e a área de folíolos/ha. Estômatos – Face superior da folha foram quatificados 8.327 e na inferior 21.209/cm2.
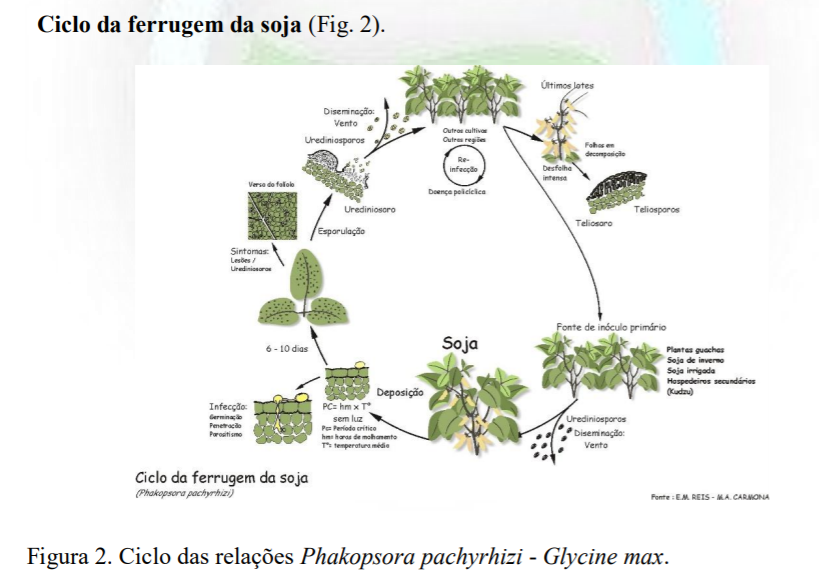
A ferruguem. A ferrugem asiática da soja (FAS), causada pelo fungos Phakopsora pachyrhizi Sydow & Sydow. foi descrita no Japão, in 1902 sobre Glycine max subsp. soja (Hennings, 1903) e, posteriormente, em Taiwan, em 1914, no hospedeiro Pachyrhizus erosus (L.) Urb., por Sydow & Sydow (1914).
No Paraguay foi constatada em 2001 (Morel, 2001) e no Brasil em 2001 (Yorinori et al., 2005) presente há 17 anos. Hospedeiros. Os hospedeiros são todos da família Fabaceae (Slaminko et al., 2008). Naturalmente P. pachyrhizi infecta 31 espécies de leguminosas em 17 gêneros (McBride, 1998; Sinclair & Hartman, 1996). Por outro lado, o fungo tem sido relatado como capaz de infectar e esporular, no campo, em 35 espécies, de 18 gêneros, da subfamília Papilionoideae, família Fabaceae.
Citam-se como os principais hospedeiros Glycine max, G. soja, Pachyrhizus erosus, Pueraria lobata (Fig. 1) e Vigna unguilulata (Cabi, 2001). Complementando, Yeh et al. (1981) relatam que o fungo pode atacar até 87 hospedeiros e Bromfield (1986), até 95. A mais recente e completa lista de hospedeiros foi publicada por Slaminko et al. (2008).
O fungo Phakopsora pachyrhizi. Posição sistemática (Alexopoulos; Mims; Blackwell,1996).
- Reino: Fungos
- Classe: Basidiomycetes (basídias produzidas nos teliosporos)
- Ordem: Uredinales
- Família: Phakopsoraceae (teleosoro em crosta subepidérmica)
- Nome atual: Phakopsora pachyrhizi Sydow & Sydow
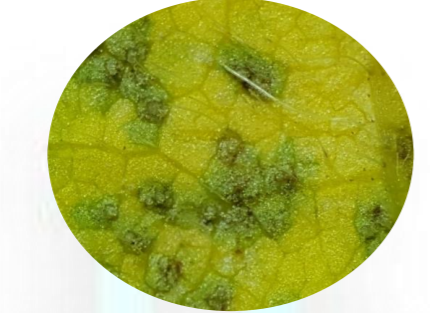
Lesões e urédias. Como nas demais ferrugens, em P. pachyrhizi, a produção de esporos ocorre em pústulas ou urédias. O conjunto da lesão com urédia esporulante é aqui denominado de sintoma/sinal. Portanto, sintoma/sinal, refere-se a urédia (s) com presença de esporos: uma ‘urédia’ isolada sem lesão; um conjunto de urédias na ‘área’ sem lesões; uma ‘lesão’ ou uma área necrosada com urédias; lesões unidas com várias urédias. A forma e tamanho das lesões, bordos angulares, é delimitada pelas nervuras (Fig. 3)
Uredosporos.
Os uredosporos, esporos assexuais, binucleados, originam-se em bases curtas dentro da urédia globosa; são globosos ou subglobosos, ovais ou elipsóides, hialinos a pardo-amarelados, densamente equinulados (Fig. 3)
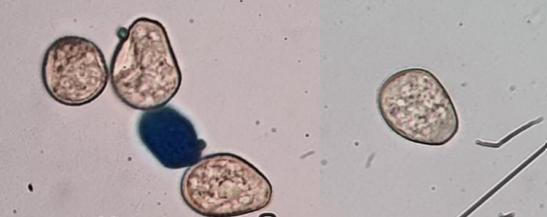
Dependendo do conteúdo de água, medem cerca 13 – 29 x 18 – 30 m com média de 18 x
23 m de comprimento. Segundo Ono et al. (1992), os uredosporos medem 18-34 x 15-24 µm e o tubo germinativo de 5 a 400 µm, Dados mostram que até 80% dos uredosporos formam apressórios e sobre folhas requerem 18 h de molhamento na faixa térmica de 22 – 25oC
Teliosporos.
Phakopsora pachyrhizi produz em télias, teliosporos irregularmente distribuídos em camadas de 2 a 7 esporos, paredes amarelo-pardo-claros ou hialinos com 1,0 m de espessura e de até 3,0 m nos esporos mais externos da camada (Saksirirat e Hoppe, 1991) (Fig. 4)
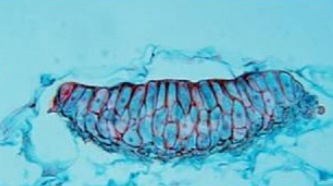
Os teliosporos germinam formando uma basídia levemente curva ostentando 1 – 4 basidiosporos. Quanto às dimensões, o comprimento das basídias é de 34 – 80 m (média 50,2 m) e a largura 5 – 10 m (média de 5,2 m). O comprimento dos esterigmas é de 9 – 21m (média 15 m). Os basidiósporos, esporos sexuais, apresentam forma ovóide, algumas vezes alantoide, com 7 – 11 m de comprimento (média 9,1 m) e 5 – 7 m de largura (média de 5,2 m).
Ainda não foi relatada a ocorrência natural de teliosporos de P. pachyrhizi no Brasil. A ferrugem. Num estudo de caso, a FAS foi detectada no dia 25 de Janeiro com 1,85% de incidência foliolar no estádio R1, aos 44 dias após a semeadura, independentemente do préfechamento das linhas de semeadura. Nesse estudo de caso, em média, as hastes de 10 plantas tinham 14, 2 nós, 62, 5 folíolos e a área dos dos folíolos de 75, 5 cm2 , os sintomas/sinais estavam concentrados nos folíolos inseridos no 5 th, 6th, e 7th nós.
Desenvolvimento das urédias e esporulação. O primeiro sintoma no desenvolvimento da
urédia é a formação de domos, elevação da epiderme foliar (Fig. 5).
As urédias surgem 9 dias após a inoculação em plantas expostas a fotoperíodo de 12 h de luz a 25oC e 12 h de escuro a 20oC, porém, surgem aos 18 dias após incubação a 12 h de luz a 20oC e 12 h de escuro a 15oC.
Os uredosporos diferenciam-se do 7o ao 9o dia, momento em que rompe o tecido epidérmico sobre a urédia (domo), formando o ostíolo e liberando os esporos. Novas urédias continuam a se formar até ao 28o dia após a inoculação; outras fontes citam até ao 42o dia. Uma urédia individual produz esporos durante 21 dias e aos 27 dias paralisa o processo (Fig. 6).
A densidade de urédias por lesão é maior na superfície inferior da folha; e aumenta marcadamente com o tempo na face inferior (Melching et al., 1979). As urédias iniciaram a esporulação no 13o dia após a inoculação e finalizando no 52o dia (Melching et al., 1979); a vida (período de esporulação) de uma urédia ou lesão foi de 39 a 55 dias; e em outro estudo, uma urédia individual esporula por 28 dias (Melching et al., 1979).
A maior densidade de urédias foi produzida na temperatura de 25ºC, entretanto, uma cultivar, a BRS 246 RR apresentou 372,7 urédias/cm2 e a BRSGO 7560, 231,6 urédias/cm2 (Danelli et al., 2015) O número de urédia por lesão pode chegar a 14 na face abaxial e a 4 na adaxial. Em amostras de folhas da safra 2003 coletadas na Universidade de Passo Fundo foram contadas até 16 urédias/lesão (Reis et al., 2004).
Esporulação.
Em relação ao número de esporos produzidos por lesão, um isolado da Austrália produziu 2.028; um da Índia, 3.768; um da Indonésia, 6.268 e um de Taiwan, 6.600, isso num período de 39 dias. Em outro estudo, a produção de esporos ocorreu num período de 36 dias e a média total de esporos produzidos foi de 12.646 por lesão. Um grama de esporos pode conter até 4 x 108 urediniosporos (Melching et al., 1979).
Em outro estudo com folíolos apresentando alta severidade da FAS, foram estimados 100.180,451 esporos/cm2; 7.563.624, 05 esporos/folíolo (75, 5 cm2); e 474.239.228 sporos/planta (62.7 folíolos) (Reis et al., in press) (Fig. 7)
 Figura 7. Nuvem de uredosporos liberada de plantas de soja com alta severidade.
Figura 7. Nuvem de uredosporos liberada de plantas de soja com alta severidade.
Disseminação, esporos secos por correntes aéreas.
Distância do transporte dos uredosporos. Como citado por Christiano e Scherm (2007), nos Estados Unidos, a disseminação anemófila de uredosporos de P. pachyrhizi foi estimada, numa média, de 8,8 e 10.4 km/dia nas safras de 2005 e 2006 respectivamente. Deposição nos sítios de infecção. São considerados sítios de infecção todos os tecidos verdes fotossintetizantes sendo as folhas os principais.
Germinação de esporos.
Requerimentos térmicos. Os requisitos térmicos para a germinação de esporos de P. pachyrhizi foram estudados em detalhes por Blum et al. (2015). A germinação máxima do uredosporo de P. pachyrhizi foi obtida a 21,8 e 22,3°C, e o comprimento máximo do tubo germinativo a 21,4 e 22,1°C. A germinação máxima de uredosporos foi encontrada com 6,4 horas de exposição, enquanto o comprimento máximo do tubo germinativo foi obtido com 7,7 horas de exposição. O limite térmico inferior foi de 4oC, o superior de 34oC e a temperatura ótima para germinação máxima de 22,2oC.
Efeito da luz. Em relação ao fotoperíodo, a germinação máxima dos esporos e o comprimento máximo do tubo germinativo do uredosporo foram encontrados no escuro. Nem a germinação de esporos nem o crescimento do tubo germinativo de uredosporos foram completamente inibidos pela exposição à luz contínua (Blum et al., 2015).
O processo infeccioso. Em P. pachyrhizi, o processo infeccioso requer > 8 horas diárias de molhamento foliar contínuo. A severidade máxima (16 urédias/cm2) foi obtida a 18oC e com 8,7 h de molhamento foliar contínuo (Melching et al., 1979); Danelli et al (2015) mostraram que a infecção da soja por P. pachyrhizi não ocorre em temperaturas ≥ 30oC, confirmando o estudo de Marchetti et al. (1976) de que em plantas incubadas a 27,5ºC não ocorre a infecção independente da duração do período de molhamento
Viabilidade dos uredosporos.
Patil et al. (1998), na Índia, relataram a viabilidade de esporos por 55 dias em folhas destacadas, umas sobre as outras e protegidas pela sombra de uma árvore. Segundo Godoy and Flausino (2004), os uredosporos permaneceram viáveis por 17 dias na bancada do laboratório. Os uredosporos foram mortos em 4 dias a temperatura de 40 a 50oC, em 8 dias a 30oC e em 18 dias a 25oC (Twizeyimana & Hartman, 2010). Uredosporos em placas de petri plásticas vazias e expostas diretamente à radiação solar foram mortos em 5 horas (Nicolini et al., 2010).
Danos causados à soja.
Num estudo de caso, a intensidade da ferrugem foi quantificada em 40 folíolos/ planta (total 360) escaneados em estereomicroscópio (20 a 50 x) correspondendo a uma área total de 27.180 cm2. A distribuição dos sintomas/sinais na lâmina foliar foi irregular com a presença de aglomerados de sintomas sinais, com ou sem lesões, de 6, 14, 42, 49, 50, 77, até mais de 100/folíolo. Os sintomas/sinais concentraram-se nos folíolos inserido no 5º, 6º nós da planta.
Os pioneiros em publicar função de dano para a ferrugem da soja foram Hartmann et al. (1991) gerando a função R = 1000 – 6,77 S (onde R é o rendimento de grãos e S a severidade foliolar; num rendimento de grãos de 1000 kg/ha, 1,0% de severidade (S) reduziu 6,77 kg/ha).
Na safra 2006/2007 em Passo Fundo, foram desenvolvidas duas funções de dano para a cultivar CD 214 nos estádios fenológicos R5.3: R= 3055,63 – 78,29 L com R2= 0,64 e p = 0,000002 e R6, R= 3186,5 – 25,13 L com R2= 0,81 e p = 0,0002 onde o R é o rendimento e o L é o número de lesões/cm2 o dano máximo no experimento foi de 56, 56 % (Zanatta, 2007).
Outros exemplos:
- (i) para o número de lesões (L)/cm2 , cultivar BRS GO 7560, R = 1.000 – 80,63 L; para a cultivar BRS 246 RR, R = 1.000 – 60,51 L;
- (ii) para a densidade de urédias (U) /cm2 , cultivar BRS GO 7560, R = 1.000 – 46,35 U; para a cultivar BRS 246 RR, R = 29,74 U;
- (iii) para a incidência (I) foliolar, cultivar BRS GO 7560, R = 1.000 – 5,61 I; para a cultivar BRS 246 RR, R = 1.000 – 6,08 (Danelli et al., 2017);
- (iv) para a severidade foliolar, R = 1.000 – 4,4 S (n = 18) (Reis et al., 2021).
Essas funções permitem estimar a quantidade de dano que equivale ao custo da aplicação de fungicida para seu controle, segundo Mumford & Norton (1984).
Desfolha.
A desfolha causada pela ferrugem iniciou com a presença de 57,4 sintomas/sinais/cm2 ou 4.248, 4/folíolo (Reis dados não publicados). A desfolha depende da severidade, portanto sua avaliação é suficiente, sugerindo que a desfolha pode ser excluída da avaliação para este patossistema, portanto, a duplicação das avaliações de desfolha e severidade não é justificável (Reis et al, (2019) (Fig. 8).
Figura 8. A desfolha da soja pela ferrugem é função de sua severidade.
Pode se observar nos folíolos basais senescentes, a presença de ‘ilhas-verdes’ à semelhança do descrito para as ferrugens e oídios em cereais de inverno (Fig. 9). Não se encontrou na literatura consultada o relato desse fenômeno com P. pachyrhizi em G. max.
Figura 9. Presença de ‘ilhas-verdes’ em folíolos basais em senescência.
Referências
Alexopoulos, C. J.; Mims, C. W.; Blackwell, M. Introductory mycology. John Willey & Sons;
inc. New York, 1996.
Blum, M.M.C.; Reis, E. M.; Franciei, T.V., Carlini, R. In vitro effect of substrate, temperature and photoperiod on Phakopsora pachyrhizi urediniospore germination and germ tube growth. Summa Phytopathologica, v.41, n.2, p.101-106, 2015
Christiano, R., & Sherm, H. (2007). Quantitative aspects of the spread the Asian soybean rust in
Danelli, A. L. D., Reis, E. M., & Boaretto, C. (2015). Critical-point model to estimate yield loss caused by Asian soybean rust. Summa Phytopathologica, 41(4), 262-269. https://doi.org/10.1590/0100-5405/2003
Danelli, A.L.D.; Reis, E.M. Quantification of incubation, latent and infection periods of Phakopsora pachyrhizi in soybean, according to chronological time and degree days. Summa Phytopathologica, v.42, n.1, p.11-17, 2016.
FAO (Food and Agriculture Organization). (1986). Crop yield response to water (pp. 15-117, Irrigation and Drainage Paper 33).
Farias, J. R. B., Nepomuceno, A. L., & Neumaier, N. (2007). Ecofisiologia da soja (Circular Técnica 48). Londrina, PR. ISSN 1515-7860.
Godoy, C.V. & Flausino, A.M. (2004). Efeito da temperatura na germinação de uredosporos de Phakopsora pachyrhizi, viabilidade e sobrevivência em diferentes condições de armazenamento. Fitopatologia Brasileira, Brasília, v. 29, p. 124.
Hennings, V. P. 1903. [A few new Japanese Uredinaceae]. Hedwigia 42:S107-108.
Isard, S. A., Dufault, N. S., Miles, M. R., Hartman, G. L., Russo, J. M., De Wolf, E. D., & MoreL, W. (2006). The effect of solar irradiance on the mortality of Phakopsora pachyrhizi urediniospores. Plant Disease, 90, 941-945. https://doi.org/10.1094/PD-90-0941
Marchetti, M.A., Melching, J. S., & Bromfield, K. R. (1976). The effects of temperature and dew period on germination and infection by uredospores of Phakopsora pachyrhizi. Phytopathology, St. Paul, v.66, p.461-463.
Munford, J.D.; Norton, G.A. Economics of decision making in pest management. Annual Review of Entomology, Palo Alto, v.29, p.157-174, 1984.
Melching, J.S.; Bromfield, D.K.; R.; Kingsolver, C.H. (1975). Infection, colonization and uredosporos production on Wayne soybean by four cultures of Phakopsora pachyrhizi. Phytopathology, St, Paul, v, 65, p.822-823.
Morel, W. (2001). Roya de la soja. Comunicado técnico – Reporte oficial. Serie Fitopatológicano 1 – Juño de 2001. Ministerio de Agricultura y Ganaderia. Subsecretaria de Agricultura. Dirección de Investigación Agrícola. Centro de Investigación Agrícola (CRIA) Capitán Miranda, Itapúa, Paraguay
Nicolini, F., Reis, E. M., Zoldan, S. M., Danelli, A. D., Zanatta, M., Avozani, A., Garces, F. R.
(2010). Effect of solar irradiation on the Phakopsora pachyrhizi uredospores germination. XLIII
Congresso Brasileiro de Fitopatologia, 2010, Cuiabá. Tropical Plant Pathology – Suplementos
(Vol. 35, p. S143).
Reis, E.M.; Zanatta, M.; Reis, A.C. Relationship between soybean plant defoliation and Asian soybean rust severity. Summa Phytopathologica, v.45, n.3, p.252-254, 2019.
Schneider, R. W.; Hollier, C. A.; Whitam, H. K. First report of soybean rust caused by Phakopsora pachyrhizi in the continental United States. Plant Disease, v. 89, p. 774, 2005.
Slaminko, T.L.; Miles, M.R.; Marois, J.J.; Wright, L.; Hartman, G.L. Hosts of Phakopsora pachyrhizi identified in field evaluations in Florida. Plant Health Progress doi:10.1094/PHP2008-1103-01-RS, 2008.
Sydow, H. & Sydow, P. (1914). A contribution to knowledge of parasitic fungi of the island of Formosa. Annales Mycologici, v. 12, p. 108. Yorinori, J.T., Paiva WM, Frederick RD, Costa Milan LM, Bertagnolli PF, Hartman GL, Godoy CV, Nunes Junior J: Epidemics of soybean rust (Phakopsora pachyrhizi) in Brazil and Paraguay from 2001 to 2003. Plant Disease. 2005, 89: 675-677. 10.1094/PD-89-0675.