Inseticidas são ferramentas essenciais na proteção de culturas agrícolas, inclusive da soja. Os ingredientes ativos disponíveis atualmente são classificados pelo Comitê de Ação contra Resistência a Inseticidas (IRAC) em cerca de 30 grupos diferentes, cada qual apresentando um modo de ação distinto. Hoje falaremos sobre os inseticidas pertencentes aos grupos 11 e 31: disruptores microbianos da membrana do mesêntero e disruptores virais da membrana peritrófica, respectivamente.
Os inseticidas microbiológicos são formulados à base de microorganismos capazes de infectar, incapacitar e matar insetos. Esses microorganismos incluem vírus, bactérias, fungos, protozoários e nematóides, ou as toxinas produzidas por eles. Os mecanismos de ação são variados e altamente específicos para determinadas espécies de insetos, de modo que cada aplicação pode resultar no controle de apenas uma porção do complexo de pragas presente na lavoura. Os inseticidas microbiológicos mais importantes e utilizados têm como base a bactéria Bacillus thuringiensis (Bt), sendo classificados no grupo IRAC 11 (disruptores microbianos da membrana do mesêntero). Esse grupo inclui as plantas transgênicas capazes de expressar toxinas Bt, como a soja Intacta®.
Bacillus thuringiensis é uma bactéria gram-positiva e esporulante, descoberta em 1901 no Japão como patógeno do bicho-da-seda (Bombyx mori). Dez anos depois, uma cepa semelhante foi descoberta infectando traças-da-farinha (Ephestia kuehniella) na região alemã da Turíngia, de onde herdou seu nome científico. Como a maioria dos organismos patogênicos, B. thuringiensis age apenas sobre um pequeno número de espécies hospedeiras. Desde sua descoberta, mais de 100 cepas diferentes de Bt já foram isoladas, com ação sobre diferentes grupos de insetos-alvo. As mais importantes são a kurstaki, usada contra lepidópteros (lagartas); a israelensis, empregada no controle de dípteros (moscas e mosquitos); e as san diego e tenebrionis, que apresentam efeito sobre coleópteros (besouros). Já B. sphaericus e B. firmus são espécies aparentadas com B. thuringiensis, capazes de controlar larvas de mosquitos e certas espécies de nematóides, respectivamente.
A transmissão do Bt ocorre por meio de esporos: células bacterianas dormentes capazes de resistir ao calor, dessecação e até radiação. Esses esporos contêm material genético, citoplasma e todas as substâncias necessárias para a sobrevivência da bactéria, em uma forma de animação suspensa; além disso, permanecem encapsulados no interior de cristais, que facilitam a infecção dos insetos hospedeiros. Após serem digeridos pelo inseto suscetível, os cristais se dissolvem, liberando proteínas tóxicas que destroem a membrana do mesêntero (intestino médio) e permitem a proliferação das células bacterianas. Microorganismos oportunistas somam-se à infecção inicial, levando o inseto à morte por um processo de infecção generalizada denominado sepse ou septicemia. Ao final da infecção, quando o corpo em decomposição do inseto torna-se inabitável, as bactérias entram novamente em fase de esporulação, reiniciando o ciclo de infecção em um novo hospedeiro.
Figura 1. Mecanismo de ação dos inseticidas Bt: como as toxinas contaminam o inseto.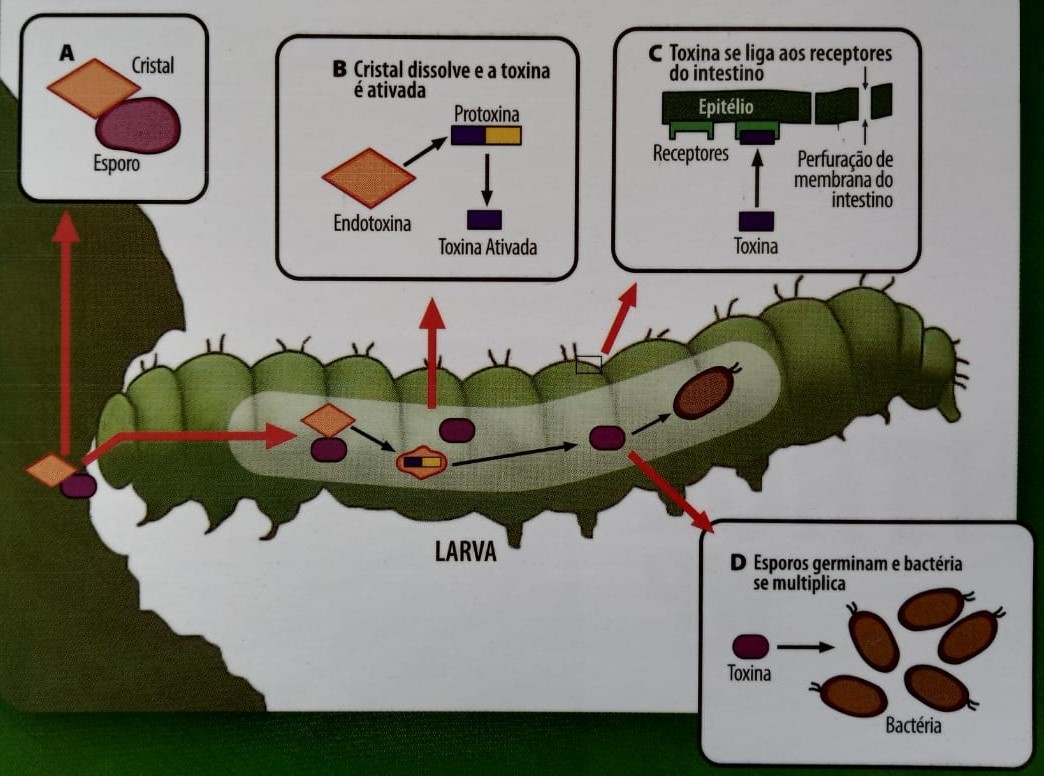
Fonte: Araunah Agro.
Os cristais Bt dissolvem-se apenas sob condições de pH alcalino, encontradas no intestino de certos insetos (como as lagartas). Esse é o motivo pelo qual são inofensivos aos demais animais (incluindo humanos), que apresentam sistema digestivo predominantemente ácido. Várias toxinas podem ser liberadas após a dissolução do cristal, mas apenas as chamadas proteínas Cry (de “crystal”) são utilizadas em inseticidas e plantas transgênicas. Mais de 500 proteínas Cry, pertencentes a 67 classes diferentes, já foram identificadas em variadas cepas de Bt. A Figura 2 ilustra detalhadamente a forma como as proteínas Cry rompem a membrana intestinal das lagartas.
Tratam-se na verdade de protoxinas, sendo necessárias duas transformações sucessivas no interior do hospedeiro para que as toxinas tornem-se ativas. Primeiro, enzimas digestivas quebram as protoxinas, liberando os monômeros ativos (1). Esses monômeros ligam-se a proteínas denominadas caderinas (2) e perdem um fragmento N-terminal denominado hélice α-1 (3), permitindo que quatro monômeros se agreguem em um tetrâmero (4). Este, por sua vez, fixa-se a um receptor secundário (ALP ou APN) na membrana epitelial do intestino e é parcialmente inserido na membrana (5), formando um poro que permite a perda de fluidos e compromete a integridade do intestino (6). Embora a morte do inseto possa demorar alguns dias, a alimentação cessa logo após a ingestão dos cristais Bt.
Figura 2. Mecanismo de ação dos inseticidas Bt: como as proteínas Cry rompem a membrana intestinal do inseto.
Fonte: SALGADO, V. L. (2013). Confira a imagem original Clicando aqui
Esporos e cristais Bt têm sido formulados e pulverizados em cultivos agrícolas desde 1938. Devido à sua alta especificidade, são considerados produtos altamente seguros, sendo inclusive aprovados para utilização em cultivos orgânicos. Por outro lado, sua eficácia de controle pode ser reduzida pela exposição ao calor intenso e radiação ultravioleta, podendo haver a necessidade de múltiplas aplicações para que se obtenha o controle satisfatório. Portanto, condições adequadas de armazenagem e aplicação são essenciais para garantir a efetividade desses produtos. Exemplos de inseticidas formulados com Bt incluem Sentry® (B. thuringiensis israelensis), Javelin® (B. thuringiensis kurstaki) e Novodor® (B. thuringiensis tenebrionis).
Um avanço importante na utilização de proteínas Bt ocorreu em 1996, quando inovações em engenharia genética tornaram possível introduzir, em linhagens de plantas agrícolas, os genes bacterianos responsáveis pela produção de toxinas inseticidas. Variedades de algodão, milho, batata e soja modificadas geneticamente para produzir toxinas Bt foram gradualmente introduzidas no mundo tudo, contribuindo para uma redução significativa no uso de inseticidas contra lepidópteros e coleópteros nessas culturas. Em 2011, por exemplo, estima-se que 65% do milho e 75% do algodão cultivados nos EUA eram compostos por variedades Bt.
A prevenção do surgimento de resistência tem sido uma preocupação crescente desde a introdução das variedades Bt. A principal estratégia combina a expressão de altas doses de proteínas Cry nas plantas com o plantio de áreas de refúgio (ou seja, variedades não-Bt cultivadas próximas às lavouras Bt), possibilitando que insetos suscetíveis sobrevivam e acasalem com os indivíduos resistentes à cultura transgênica. Como os genes que conferem resistência ao Bt são recessivos, a prole resultante de uma união entre indivíduos suscetíveis e resistentes apresenta suscetibilidade à tecnologia, e torna-se incapaz de sobreviver na lavoura transgênica. Essa estratégia tem sido recomendada para todas as culturas Bt e, onde não utilizada, casos de resistência têm sido detectados. O principal mecanismo de resistência consiste em uma modificação na proteína caderina, tornando-a incapaz de reconhecer os fragmentos ativos da toxina e ligar-se a eles. Essa mutação já foi detectada em várias espécies de lepidópteros, mas é instável e pode regredir na ausência de pressão de seleção.
As toxinas Bt são altamente seletivas para uma limitada gama de insetos-alvo e, portanto, apresentam riscos mínimos de contaminação para outros organismos. Desse modo, os produtos formulados à base de Bt são considerados extremamente seguros. O mesmo se aplica às cultivares Bt e os alimentos transgênicos, que não apresentam efeitos nocivos sobre os consumidores. A principal preocupação com as culturas transgênicas tem sido de ordem ambiental, no que se refere ao seu efeito potencial sobre insetos não-alvo e possibilidades de interação gênica com outras espécies de plantas. Entretanto, estudos de longa duração não detectaram tais efeitos negativos das plantas Bt, e a ampla adoção dessa tecnologia tem contribuído significativamente para reduzir o uso de inseticidas no mundo todo (Informa Healthcare USA Inc., 2013).
Embora sejam organismos diferentes, os baculovírus atuam nos insetos de forma semelhante às bactérias Bt: destruindo a membrana interna do intestino de lagartas. São classificados como o grupo 31 de modos de ação: disruptores virais da membrana peritrófica. Tratam-se de patógenos naturais amplamente utilizados na agricultura devido a sua alta especificidade de hospedeiro, segurança e facilidade de aplicação. O processo de infecção viral é caracterizado pela produção de dois fenótipos virais: ODV (“occlusion derived virus”, vírus derivado de oclusão) e BV (“budded virus”, vírus brotado).
O ODV é responsável pela infecção primária no intestino médio do inseto, enquanto os BVs são responsáveis pela infecção secundária ou sistêmica, de célula a célula (Sosa-Gómez et al., 2020). Os ODVs ficam encapsulados dentro de uma matriz cristalina protéica denominada corpo de oclusão (“occlusion body”; OB), que protege os vírus das adversidades ambientais.
Figura 3. Morfologia do corpo de oclusão e representação dos fenótipos virais de baculovírus: (A) corpo de oclusão; (B) corte transversal no OB, contendo vários ODVs (responsáveis pela infecção primária); (C) BV ou vírus brotado, responsável pela infecção sistêmica ou secundária.
Fonte: Lucas Boeni de Oliveira.
A infecção se inicia quando o inseto ingere os OBs que estão presentes naturalmente no ambiente ou que foram pulverizados na lavoura. No intestino médio da lagarta, mediante pH alcalino, os OBs se dissolvem e liberam os ODVs, que atravessam a membrana peritrófica e infectam as microvilosidades das células epiteliais (infecção primária). A infecção ocorre no núcleo das células, que passam produzir os BVs e infectar as células adjacentes (infecção secundária ou sistêmica).
Na fase tardia da infecção, são produzidos novos ODVs, protegidos no interior de OBs; após a morte do inseto, o seu corpo se liquefaz e libera novamente no ambiente os poliedros virais, perpetuando a infecção em novos hospedeiros. As lagartas mortas por infecção de baculovírus apresentam aspecto pálido e são encontradas penduradas no dossel superior das plantas de soja. O processo total de infecção dura sete dias, sendo que após quatro dias as lagartas cessam sua alimentação.
Figura 4. Lagarta-da-soja (Anticarsia gemmatalis) infectada por baculovírus.
Fonte: Lenen Peterson
De acordo com seus hospedeiros, os baculovírus são agrupados em quatro gêneros. Alphabaculovirus e Betabaculovirus infectam larvas de lepidópteros, Gammabaculovirus infectam larvas de himenópteros e Deltabaculovirus infectam larvas de dípteros (Jehle et al., 2006). Com base na morfologia do corpo de oclusão, eles também podem ser divididos em nucleopolyhedrovirus (NPV), que possui OBs com formato poliédrico e granulovírus (GV), que possui OBs com formato granular. Devido à sua alta especificidade, são considerados inseticidas altamente seguros e registrados para uso na agricultura orgânica. No Brasil, o uso do baculovírus Anticarsia gemmatalis multiple nucleopolyhedrovirus isolado 2D (AgMNPV-2D) foi muito disseminado na safra de 2003/2004, quando foi utilizado em cerca de 2 milhões de hectares de soja. Posteriormente, o uso desse isolado diminuiu devido ao crescimento em importância de outra praga da soja, a falsa-medideira (Chrysodeixis includens). Para saber mais sobre o controle de lagartas com baculovírus, acesse: https://maissoja.com.br/como-funciona-o-controle-de-lagartas-com-baculovirus/
Com o estudo dos inseticidas à base de Bt e baculovírus, encerramos essa série de quinze textos abordando os principais modos de ação dos inseticidas. A reprodução desse texto, ou partes dele, deve ser precedida de autorização dos autores e acompanhada de citação da seguinte fonte: POZEBON, H.; ARNEMANN, J. A. Como funcionam os inseticidas à base de Bt e baculovírus?. Portal Mais Soja. 2021. Disponível online.
Revisão: Prof. Jonas Arnemann, PhD. e coordenador do Grupo de Manejo e Genética de Pragas – UFSM

REFERÊNCIAS:
IRAC. 2018. Mode of Action Classification Scheme.
Disponível em: https://www.irac-online.org/documents/moa-structures-poster-english/?ext=pdf
JEHLE, J. A. et al. 2006. On the classification and nomenclature of baculoviruses: a proposal for revision. Archives of virology, v. 151, n. 7, p. 1257-1266, 2006.
SALGADO, V. L. 2013. BASF Insecticide Mode of Action Technical Training Manual. Disponível em:https://agriculture.basf.com/global/assets/en/Crop%20Protection/innovation/BASF_Insecticide_MoA_Manual_2014.pdf
SOSA-GÓMEZ, D. R. et al. 2020. Entomopathogenic Viruses in the Neotropics: Current Status and Recently Discovered Species. Neotropical entomology, 2020.






[…] Além do milho, da soja e do algodão, que já possuem variedades Bt disponíveis comercialmente há alguns anos, estudos vêm sendo conduzidos para viabilizar a transformação genética via Agrobacterium em arroz, de forma estável e eficiente. Para saber mais sobre o mecanismo de ação das proteínas Bt, clique aqui. […]
[…] Como funciona a aplicação de Bacillus thuringiensis. Fonte: https://maissoja.com.br/como-funcionam-os-inseticidas-a-base-de-bt-e-baculovirus/ […]