Tem sido observado por fitopatologistas que sempre numa cultura uma doença domina a cena numa safra. Por exemplo, em soja [Glycine max (L.) Merr] após a safra 2003/04 no Rio Grande do Sul, a ferrugem asiática da soja, casado pelo fungo basidiomiceto Phakopsora pachyrhizi Sydow & Sydow, tem sido a doença dominante. Nessa situação tem sido difícil quantificar a intensidade das demais doenças que normalmente ocorrem nessa cultura. Porém, como a ferrugem surge mais tarde no ciclo da soja, tem sido fácil a diagnose e a quantificação da antracnose causando desfolha inicial na soja (Reis et al. .2021).
Fato marcante ocorreu na safra 2021/22. Devido à seca, causando prejuízo na soja semeada na época normal não foi detectado tanto sintomas/sinais da ferrugem bem como a presença de esporos no ar (Aerobiologia). Na semeadura em dezembro, com a regularização da frequência e volume das chuvas, houve melhor desenvolvimento da soja, porém, também na ausência da ocorrência da doença dominadora da cena a ferrugem.
Nos experimentos de controle de doenças da soja com fungicidas, conduzidas no campo experimental do Instituto Agris, observou-se um efeito de alguns tratamentos fungicidas em manter a área foliar verde por mais tempo e reduzindo a desfolha. Lembro que como não foi detectada a presença da ferrugem, tentou-se inicialmente explicar o fenômeno pela presença de efeito, nutritivo, ou ‘verde’ e etc., de alguns fungicidas na ausência de doença (s). Nesse sentido, lembra-se que o mancozebe pela presença do manganês (22%) em sua composição aumenta o teor de clorofila na folhagem da soja (Reis et al., 2021) e de compostos ou produtos químicos com efeito estimulante no crescimento e desenvolvimento de espécies vegetais como as estrobilurinas (KÖHLE et al., 2002).
A redução da área foliar sadia e a desfolha foi causada por epidemia do crestamento de cercospora da soja, causado por Cercospora kikuchii (Matsumoto & Tomoyasu) Gardner.
Portanto, nessa safra 2021/22, nessa situação, a doença que dominou a cena, na ausência da ferrugem, foi o crestamento de cercospora. Portanto, o efeito da aplicação de fungicidas em manter a área foliar sadia por mais tempo e retardando a desfolha foi o efeito sobre C. kikuchii.
A primeira referência do crestamento de cercospora foi feita em 1921, por Susuki, no Japão, tendo atribuiu como causa da doença, fatores climáticos. Mais tarde, Matsumoto e Tomoyasu, também no Japão, demonstraram que o agente causal era um fungo, que o descreveram como Cercosporina kikuchii, após ter R. Kikuchi encontrado o mesmo organismo em sementes de soja em 1922. Nos Estados Unidos, Gardner constatou doença semelhante em sementes de soja em 1924 e o primeiro relato da doença no Brasil foi feito por Gomes em 1963 (Gomes, 1966).
Etiologia. O agente causal do crestamento de cercospora é um fungo pertencente à Classe dos Deuteromicetos, Ordem Moniliales, Família Dematiaceae e Gênero e espécie Cercospora kikuchii (Matsumoto & Tomoyasu) Gardner. Em média os conídios medem 210 x 3,3 µm e com 2 a 49 septos por esporo (Fig. 1).
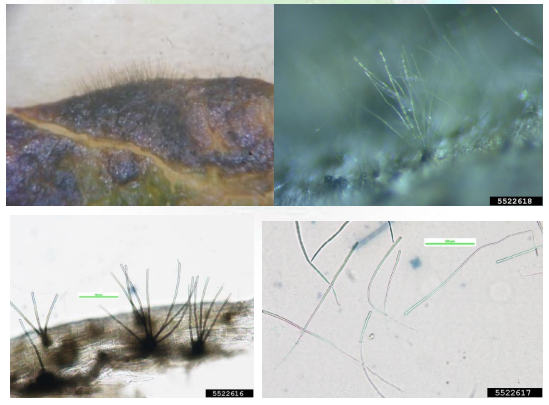
Hospedeiro. Até o momento desta publicação, o único hospedeiro conhecido é a soja. Sintomatologia: Em folíolos surge como ‘arroxeamento’ seguido de necrose (morte dos tecidos) (Fig. 2).

Cercospora kikuchii em soja.
Em plantas – queda das folhas severamente atacadas, inicialmente os pecíolos se mantém na planta e com o passar do tempo, caem.
Em pecíolos, hastes e vagens – manhas pequenas, irregulares em forma, de coloração avermelhada (Fig. 3).


2021).
Em sementes. Em grãos e sementes, ossintomas apresentam-se pela alteração da coloração do tegumento tornando-se avermelhado ou purpúreo e podendo atingir os cotilédones.
Desses sintomas decorre o outro nome comum da doença ‘mancha púrpura’ da semente de soja (Fig. 4).
Tem sido demonstraram que a ‘mancha púrpura’ não tem efeito negativo sobre a qualidade da semente (Henning et al., 1981).
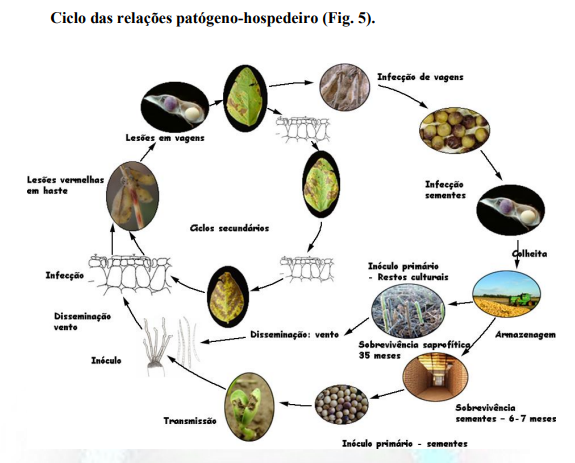
Transmissão. É o retorno do fungo da semente (cotilédones) infectada via lesões cotiledonares (Fig. 4) após a emergência da plântula. Ver transmissão semente-cotilédone Figura 5.

Fontes de inóculo. Sementes infectadas (Fig.6) introduzindo o fungo na área cultivada e
restos culturais, fase saprofítica.

Restos culturais. Resto cultural pode manter o fungo ativo poro até 35 meses (Reis et al.,
2011) até a completa decomposição ou mineralização, deixando de ser fonte de inóculo. O fungo agente causal não produz estrutura de dormência ou de repouso.
Disseminação. O fungo descrito no Japão em 1921 e daí para todos os continentes onde se cultiva a soja sempre acompanhando a semente. Outro mecanismo é o transporte do inóculo (esporos do fungo) – esporos secos, removidos dos conidióforos e transportado no ar pelo vento.
Condições climáticas e o processo infeccioso. A temperatura mais favorável ao desenvolvimento da doença é na faixa de 23 – 27ºC. As folhas podem ser infectadas com infecção latente nos estádios vegetativos, permanecendo assim até os estádios R5-R6 quando os sintomas se tornam evidentes (Ward-Gauthier et al., 2015).
Medidas de controle.
Rotação de culturas com gramíneas considerando que o tempo de decomposição do resto
cultural da soja, ou tempo de manutenção do fungo viável na lavoura, é de 35 meses (Reis et al., 2011).
Controle químico.
Tratamento de sementes. Embora o fungo seja transmitido por sementes e considerando
o cultivo da soja em monocultura e plantio direto o uso de fungicidas em sementes não é eficiente. Além desse fato, não se encontrou relato científico de que o fungicida aplicado à semente ‘mata’ o fungo que coloniza os cotilédones, evitando assim sua esporulação em lesões (Fig. 7).

via lesão cotiledonar sem comprovação de sua erradicação.
Pulverização na folhagem. A aplicação de fungicidas tem como objetivo manter a área foliar sadia por mais tempo. Um dos nomes comuns da moléstia é ‘doença de final de ciclo’ por surgir a partir dos estádios reprodutivos.
Na Argentina foi relatada a presença de isolados de C. kikuchii resistentes à estrobilurinas e benzimidazol (Sautua et al, 2020) e demonstrado que no mínimo 65–90 mm de chuva durante os estádios R3–R5 são necessários para justificar a aplicação com alta probabilidade de aumento no rendimento como consequência do controle da doença (Carmona et al., 2011).
Referências
CARMONA, M.; SAUTUA, F.; PERELMAN, S.; REIS, E.M.; GALLY. M. Relationship between late season disease complex and rain in determining grain yield response to fungicide applications. Journal of Phytopathology 159:687-693, 2011
GOMES, J. C. Avaliação da incidência de mancha purpúrea da soja (Cercospora kikuchii) sob condições naturais de campo, nas variedades do Ensaio de Regionalização. I:. Súmula dos Trabalhos Fitotécnicos na Cultura da Soja, X Reunião, 1966.
HENNING, A. A.; FRANÇA NETO, J. de B.; COSTA, N. P. da. Avaliação dos efeitos de diferentes níveis de sementes com mancha purpura, sobre a qualidade fisiológica e sanitária das sementes. ln: EMBRAPA. Centro Nacional de Pesquisa de Soja (Londrina, PR), Resultados de pesquisa de soja 1980/81. Londrina, 1981 . p.290-294.
KÖHLE, H.; GROSSMANN, H.; JABS, T.; GERHARD, M.; KAISER, W.; GLAAB, J.; CONRATH, U.; SEEHAUS, K.; HERMS, S. Physiological effects os the strobilurin fungicide F500 on plants. In: DEHNE, H, W.; GISI, U.; KUCK, K. H.; RUSSELL, P. E.; LYR, H. (Ed.). Modern fungicides and antifungal compounds III. Andover: Intercept, 2002. p. 61-74.
MURAKISHI, H. H. Purple stain of soybean. Pytopathology 41:305-318. 1951. REIS, E. M.; BARUFFI, D.; REMOR, L; ZANATTA, M. Decomposition of corn and soybean residues under field conditions and their role as inoculum source. Summa Phytopathologica, v.37, n.1, p.65-67, 2011.
REIS, E.M.; REIS, A.C.; ZANATTA, M. Etiologia da morte e queda prematura de pecíolos basais da soja. Textos técnicos. Instituto AGRIS, Passo Fundo, RS, 2021.
SAUTUA, F.J.; DOYLE, V. P.; PRICE, P.P.; PORFIRI, A.; FERNANDEZ, P.; SCANDIANI, M.M.; MARCELO A. CARMONA. Fungicide resistance in Cercospora species causing cercospora leaf blight and purple seed stain of soybean in Argentina. Plant Pathology. V.1–17, 2020. DOI: 10.1111/ppa.13261
WARD-GAUTHIER, N.A.; SCHENEIDER, R.W.; CHANDA, A.; SILVA, E.C.; PRICE, P.P.; CAI, G.
Cercospora leaf blight and purpule seed stain. In; Compendium of soybean diseases and pests. Hartmann, G.L.; Rupe, J.C.; Sickora, E. J.; Domier, L.L.; Davis, J.A.; Steffey, K.L. (Eds.). The American phytopathology society, St. Paul, Minnesota, U.S.A. p. 37-41, 2015.
Autores: Erlei Melo Reis, Andrea Camargo Reis, Carla Gabriela Tolotti, Maria Eduarda Eilert, Maria Valeska Lima Soares, Mateus Zanatta
Fonte: Instituto Agris, Pesquisa e Consultoria Agrícola Ltda – Passo Fundo, RS
Foto de capa: Mauricio Stefanelo