Introdução.
O oídio é uma doença de ocorrência frequente nas lavouras de trigo estando presente em todos os locais onde cultivares suscetíveis são cultivadas. Esta moléstia, também denominada de cinza do trigo, pode causar danos de até 62% em cultivar suscetível (Reis & Casa, 2007).
Princípio prático da fitopatologia. “Os agricultores cultivam o trigo para ganhar dinheiro e não para garantir o pão aos famintos”. Portanto, se a doença causa dano necessita ser controlada. O ciclo de uma doença é constituído pelas seguintes subfases do processo: sobrevivência do patógeno, esporulação, liberação do inóculo, remoção, transporte, deposição, germinação, penetração, colonização (parasitismo), expressão dos sintomas e esporulação nos tecidos mortos.
Assim, ao findar o ciclo primário o processo é repetido várias vezes resultando no crescimento da doença pela sucessão de ciclos secundários. O conhecimento detalhado do ciclo, ou do desenvolvimento da doença, pode contribuir para o aperfeiçoamento do seu controle pela observação do manejo integrado, sistema mais racional de controle de doenças. As estratégias de controle visam sempre interferir numa ou mais fases do ciclo da doença.
Etiologia.
O oidío é causado por fungo que na forma perfeita pertencente à Classe Ascomicetos, Ordem Erysiphales e a Família Erysiphaceae (Menezes e Oliveira, 1993) e ao Gênero e espécie Blumeria graminis Speer f.sp. tritici Em. Marchal. Na forma imperfeita pertence à Classe dos Deuteromicetos, Ordem Moniliales, Família Moniliaceae e ao Gênero e espécie Oidium monilioides (Nees.) Link.
Blumeria graminis é a única espécie do gênero Blumeria (Braun, 1987). O fungo foi originalmente descrito como um membro do gênero Erysiphe (Braun 1987). Mas, devido ao haustório digitado, micélio secundário com hifas com aspecto de cerdas, célula basal do conidióforo bulbosa ou inchada, bem como as estruturas do ascocarpo são únicas para esse fungo garantindo assim a sua separação ao nível de gênero (Braun 1987).
Morfologia do anamorfo.
Tipos de micélio. O fungo apresenta no seu desenvolvimento dois tipos de micélio, o primário e o secundário formados sobe os tecidos verdes. Micélio primário anfígeno, fino a denso, primeiramente em manchas, mais tarde efuso, branco quando jovem, ocráceo a pardo ferruginoso quando velho (Fig. 1).
Figura 1. Colônia de micélio primário de Oidium moniliodes.
Micélio secundário composto por hifas semelhantes a cerdas, inicialmente hialino, mais tarde cinza a pardo ferruginoso, asseptado, reto a curvado, falcado, paredes celulares espessas 200- 400 x 4-7 um; comumente forma feltro denso sobre os tecidos verdes.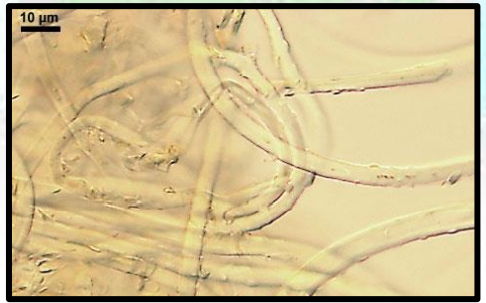
Figura 2. Micélio secundário de Oidium moniliodes.
Conidioforos eretos, catenulados, célula-pé medindo 20-40 x 5-7 µm, base bulbosa dilatada com 10 15 um de diâmetro, seguidas por células de 12,5-24 µm de comprimento. Conídios em cadeia, elipsoides a limoniformes, hialinos 32-44 µm (Fig. 3)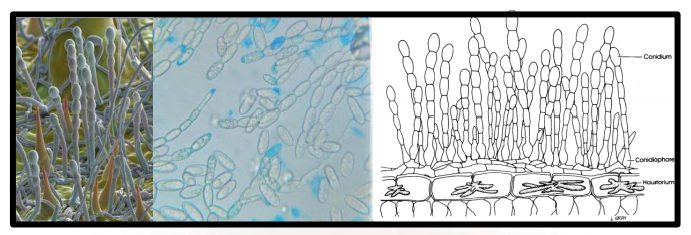
Figura 3. Oidium monilioides: Conidióforos, conídios e haustórios.
Figura 4. Conidióforos de Oidium monilioides. Em detalhe a célula basal dilatada.
Os haustórios medem 5 -10 x 0 -30 µm, com apêndices semelhantes a dedos da mão. (Fig. 5).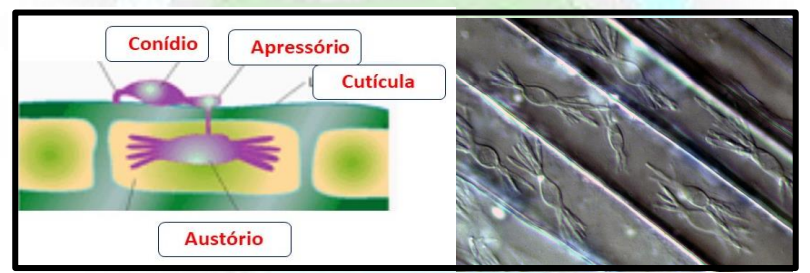
Figura 5. Detalhe de haustórios de Oidium moniliodes no interior de células epidérmica de trigo.
Morfologia do teleomorfo.
Mais tarde o micélio se compacta e forma pequenas almofadas de coloração cinza-pardas, feruginosas, as quais os cleistotécios são formados (Fig. 6). São esféricos, medindo de 135 – 280 µm de diâmetro, contendo de 6 -30 ascas. As ascas são pedunculadas, 50 -105 x 20 – 45 µm com 4 – 8 ascosporos. Apêndices micelióides pouco
numerosos, simples, hialinos, septados.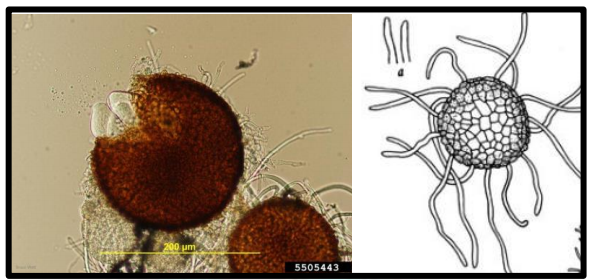
Figura 6. Cleistotécios de Blumeria graminis f.sp. tritici. À direita, cleistotécio com apêndices miceliódes.
Na fase parasitária, o oídio é um ectoparasita de modo que a grande massa de micélio, conidióforos e conídios desenvolvem-se na superfície da planta. Este conjunto forma uma colônia superficial. Os esporos são denominados de conídios. Outro tipo de frutificação, que surge nos tecidos senescidos – restos culturais na entre safra – é o cleistotécio com ascas e ascosporos (Wiese, 1977). No Brasil, ainda não foi relatada a presença de ascosporos no interior deste corpo de frutificação.
Variabilidade genética.
Este fungo, um parasita obrigado ou biotrófico, produz raças virulentas tendo sido pouco pesquisada a sua variabilidade no Brasil (Costamilan e Linhares, 2002). Apesar disso, admite-se que a variabilidade é muito grande, pois cultivares resistentes tem tido a resistência quebrada com poucas safras de cultivo. A resistência das cultivares brasileiras não é durável. Esse fenômeno é chamado de “quebra-da-resistência”.
Ciclo das relações patógeno-hospedeiro: Blumeria graminis f. sp. tritici. x Triticum aestivum L. (Fig. 7).
Sobrevivência e fontes de inóculo primário
O agente causal do oídio do trigo é um parasita biotrófico específico ao trigo, e por isso, somente sobrevive na fase parasitária em plantas de trigo voluntárias, ou guaxas, presentes em lavouras, ao longo de caminhos, estradas e rodovias (Reis e Casa, 2007). Dessas plantas, dentro ou fora da lavoura, os conídios do fungo são transportados pelo vento para as lavouras de trigo.
Por ser biotrófico, o agente causal, não está associado às sementes e aos restos culturais do trigo. Os cleistotécios formam-se sobretudo nas bainhas das folhas basais de plantas vivas e posteriormente podem ser encontrados nos restos culturais (Fig. 8). No entanto, no sul do Brasil, não são encontradas ascas e ascosporos. Por isso, é duvidoso o papel dos cleistotécios na sobrevivência do patógeno em nosso país.
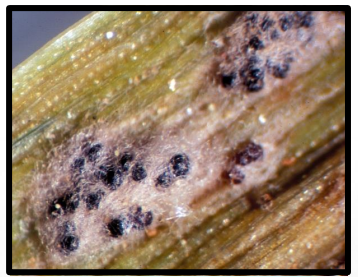 Figura 8. Cleistotécios (corpos negros) de Blumeria graminis f.sp. tritici, entremeados com o micélio e conidióforos (Oidium monilioides), sobre folha de trigo.
Figura 8. Cleistotécios (corpos negros) de Blumeria graminis f.sp. tritici, entremeados com o micélio e conidióforos (Oidium monilioides), sobre folha de trigo.
Remoção e transporte do inóculo. Os conídios são esporos secos (senso Maude, 1996) sendo por isso, removidos dos conidióforos quando a superfície da planta estiver seca. Segue-se o seu transporte pelo vento, até serem depositados nas folhas de plantas voluntárias dentro ou fora da lavoura e nas lavouras cultivadas. Os conídios, esporos infectivos e envolvidos com o desenvolvimento da doença medem 8 – 10 x 20 – 35 µm (Wiese, 1977).
Deposição, germinação e penetração. Os conídios são depositados nos órgãos fotossintéticos do trigo, sítios de infecção por sedimentação ou impacto quando levados por correntes aéreas. Para germinar não requerem o seu molhamento, pois a água inibe a germinação, emitem um tubo de germinação (Fig. 9) penetrando o hospedeiro, principalmente folhas, diretamente. Cerca de 75% do seu peso é água.
 Figura 9. Conídios germinados, emitindo dois tubos germinativos um rudimentar e outro com apressório
Figura 9. Conídios germinados, emitindo dois tubos germinativos um rudimentar e outro com apressório
Colonização.
Por ser um parasita especializado e altamente evoluído, a partir das hifas desenvolvidas na superfície do hospedeiro, emite estrutura que penetra a epiderme, ramifica-se no seu interior e explora as células do hospedeiro sem lhes causar a morte. A estrutura que extrai nutriente chama-se haustório, uma estrutura sugadora (Fig. 4). A colonização consiste no crescimento do micélio superficial, emissão de haustórios e extração de nutrientes do hospedeiro (LINHARES, 1982)
Sintomatologia.
Nesta doença a presença de sinais é mais pronunciada do que os sintomas. A doença caracteriza-se pela formação do micélio superficial em áreas limitadas ou sobre todo o tecido foliar. Por isso, muitos denominam a doença de cinza. As estruturas do fungo são chamadasde sinais (Fig. 10). Os sintomas são amarelecimento foliar, formação de ilhas verdes e morte foliar (Wiese, 1977).
 Figura 10. Sinais, micélio e frutificação, do oídio sobre folha e espiga de trigo.
Figura 10. Sinais, micélio e frutificação, do oídio sobre folha e espiga de trigo.
Ciclos secundários.
O oídio é uma doença policíclica crescendo em intensidade pelos ciclos secundários que se sucedem no cultivo, resultando no ataque de novas folhas e plantas e aumento da área foliar coberta com os sinais do fungo. A produção de esporos é abundante de modo que quando se caminha numa lavoura infestada, desprende-se uma nuvem de conídios.
Um ciclo de vida completo de conídio a conídio completa-se de 5 – 8 dias na faixa térmica de 15 – 22oC (Wiese, 1977). Para se ter ideia do potencial epidêmico do oídio, cita-se que o ciclo do trigo é de aproximadamente 135 dias e um conidióforo de Blumeria spp. pode produzir 33 conídios num período de 107 horas (Moriura et al, 2006).
Quando a lavoura de trigo entra em senescência o fungo produz a estrutura de ascomiceto, os cleistotécios, gênero Blumeria, nos tecidos mortos. Esta estrutura não deve cumprir função biológica no Brasil, pois não tem sido encontrados ascosporos em seu interior (? Necessita ser comprovado?).
Dano causado pelo oídio em cultivares suscetíveis. Para quantificar o dano a ciência gerou a função de dano, por ex. para o oídio do trigo cultivares suscetíveis, a função normalizada para 1000 kg/ha de grãos, R- 1.000 – 5,49 IF. Na Tabela 1, exercita-se o uso da função para diferentes incidências do oídio e diferentes produtividades e o dano decorrente.
Com essa ferramenta um Engenheiro Agrônomo pode determinar o momento da primeira aplicação de fungicidas visando ao controle econômico que garanta o máximo lucro ao produtor. Se uma cultivar, pela resistência genética não atinge o limiar de dano, não se deve aplicar fungicida para controle do oídio. Se não for assim, e se aplicar fungicida sem critério para que optar pela cultivar resistente?
Tabela 1. Dano estimado com a função R = 1000 – 5,47 IF para diferentes incidências folhares do oídio e distintas produtividades potenciais do trigo 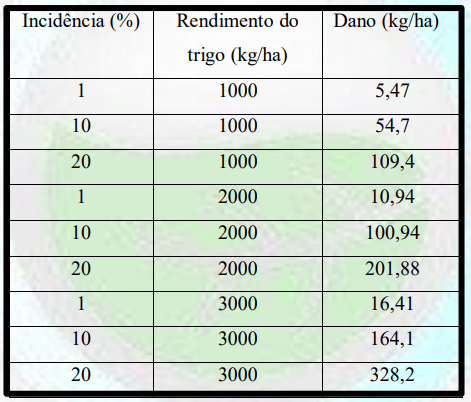
Controle.
Medidas tomadas antes da semeadura do trigo
- Eliminação de plantas de trigo voluntárias;
- No planejamento da lavoura dar preferências a cultivares resistentes. Ex. Na safra 2020 foram resistentes (R) ORS Senna, ORS 1403, ORS 1401, BRS Reponte, BRS Marcante, BRS Belajoia. Foram moderadamente resistentes (MR) ORS Ferroz, ORS Destak e ORS Agile.
- Tratamento de semente. Essa prática foi eficiente até a ocorrência da redução da sensibilidade do fungo aos fungicidas triazóis resultando atualmente num período de proteção inferior a sete dias.
- Densidade de semeadura recomendada para a cultivar.
Medidas tomadas após a semeadura
- População de plantas recomendada evitando o excesso.
- Evite excesso de cobertura nitrogenada;
Controle químico
atualmente o controle químico do oídio vem enfrentando dificuldade devido ao fungo apresentar redução da sensibilidade aos triazóis com presença das mutações Y136F e S509T no gene Cyp 51. Por isso, hoje, o fungicida mais potente tem sido o fenpropimorfo mas com período de proteção reduzido.
Segundo os princípios científicos não se deve aplicar fungicidas preventivamente, ou na
ausência da doença. Para isso, a ciência desenvolveu o critério do nível de dano econômico (Reis et al., 2020).
Imagens originais e capturadas na Internet.
Referências bibliográficas.
BRAUN U. A monograph of the Erysiphales (powdery mildews). Beih. Nova Hedwigia 89, 1-700, 1987.
COSTAMILAN, L.M. & LINHARES, W.I. Efetividade de genes de resistência de trigo a oídio. Fitopatologia Brasileira 27 p 621-625. 2002.
LINHARES, W. I. O trigo no Brasil, Fundação Cargill, Coordenação: Eduardo A. Osório Campinas,1982. p 423 – 471.
MAUDE, R.B. Seedborne diseases and the control principles and practice. Oxon: CAB Internacional, 1996.p. 70-88
MENEZES, M.; OLIVEIRA, S. M. A. Fungos Fitopatogênicos. Recife: UFRPE, 1993. 227p. MORIURA, N.; MATSUDA, Y.; OICHI, W.; NAKASHIMA, S; HIRAI, T.; SAMESHIMA, T.; NONOMURA, T.; KAKUTANI, K.; KUSAKARI, S.; HIGASHI, K.; TOYODA, H. Consecutive monitoring of lifelong production of conidia by individual conidiophores of Blumeria graminis f. sp. hordei on barley leaves by digital microscopic techniques with electrostatic micromanipulation. Mycological Research, V. 110, n. 1, January 2006, Pages 18–27.
REIS, E.M.; CASA, R.T. Doenças dos cereais de inverno – diagnose, epidemiologia e controle. Lages, 2007. 176 p.
Reis, E.M.; Zanatta, M.; Reis, Andrea, C. Controle de doenças do trigo [recurso eletrônico]: safra 2020. 3.
Ed. Passo Fundo: Berthier, 2020, 7 Mb; PDF. ISBN: 978-65-86647-03-7 REUNIÃO DA COMISSÃO BRASILEIRA DE PESQUISA DE TRIGO E TRITICALE (6.: 2012, jun. – jul. 29-2, Londrina, PR). Informações técnicas para a safra 2013: trigo e triticale. Comissão Brasileira de Pesquisa de Trigo e Triticale: Londrina. PR: Instituto Agronômico do Paraná (IAPAR), 2013. 220p.
WIESE, M.V. The powdery mildew. Compendium of wheat disease. St. Paul. The American Phytopathological Society, 1977. p. 30-31



