O texto a seguir é parte de um artigo que será publicado na Journal of Agricultural Science; Vol. 11, No. 8; 2019, pelos autores:
Thais P. Zanatta, Stela M. Kulczynski, Caroline W. Guterres, Daniele C. Fontana, Daniela Meira, Eduardo L. Ceolin, Eduardo Balem, Mateus Trevisan, Joao Antônio Paraginski & Paola A. Buffon.
1- INTRODUÇÃO
O mofo-branco, causado pelo fungo Sclerotinia sclerotiorum (Lib.), é uma doença com distribuição mundial, infectando mais de 400 espécies de plantas, com exceção de espécies da família Poaceae (JULIATTI et al., 2015). Dentre as mais importantes culturas atacadas pelo fungo estão o feijão, a soja, o algodão, o girassol, o tomate e a batata (DEMANT, 2010).
Temperaturas amenas, entre 18-23°C e condições de alta umidade, favorecem a ocorrência do patógeno. Com baixa incidência da doença por hectare, esta pode ocorrer esporadicamente e em pequenas reboleiras, não causando perdas significativas às culturas. Porém, a utilização de sementes contaminadas e/ou infectadas, safras contínuas em monocultivo, sucessão de culturas com espécies suscetíveis ou hospedeiras, temperaturas noturnas amenas (abaixo de 18 ºC), chuvas prolongadas durante o cultivo, excesso de adubações nitrogenadas e irrigação sem controle da quantidade de água fornecida (LEITE, 2005; JULIATTI & JULIATTI, 2010; SILVA et al., 2010) fazem com que o mofo-branco se dissemine, assumindo grande importância econômica e social.
Devido a abundante produção de escleródios, os quais possibilitam a sobrevivência do fungo no solo por mais de 10 anos, o mofo-branco é considerado uma doença de difícil controle (REIS; TOMAZINI, 2005). Para o bom controle de doenças é fundamental o entendimento da etiologia, da morfologia e da patogenicidade dos patógenos (KOHLI et al., 2003). Ainda existem relativamente poucas informações sobre a etiologia, patogenicidade e morfologia de S. sclerotiorum na literatura, especialmente para as condições do Sul do Brasil.
A variabilidade de isolados de S. sclerotiorum foi relatada em vários trabalhos. Em 1930, Dickson estudou 33 isolados e encontrou diferença entre a densidade de micélio, que variou de ralos a aéreos, e nas taxas de crescimento de micélio. Morral et al. (1972), estudando 114 isolados de S. sclerotiorum, oriundos de 23 hospedeiros, coletados no Canadá, verificaram variações na cor das colônias, na taxa de crescimento e abundância dos micélios e variações na quantidade, formato e tamanho de escleródios. Em 19 isolados oriundos da região do Alto Paranaíba-MG, Corradini (1989) observou grande variabilidade no que se refere ao crescimento e diâmetro de colônias, tipo e cor de micélio, produção, peso e distribuição de escleródios e na produção de apotécios.
Segundo Pariuad et al. (2009), pode-se avaliar a agressividade dos isolados de diversas formas, seja pela eficiência de infecção, pelo período latente, pela taxa de produção de esporos e pelo tamanho da lesão. Lehner et al. (2015) compararam a agressividade de 20 isolados de S. sclerotiorum e determinaram a relação entre a agressividade e a variabilidade destes. Conforme os autores foram observados níveis de agressividade semelhantes entre os isolados coletados em quatro estados brasileiros. Porém, não houve relação entre a agressividade e as características morfológicas de pigmentação micelial, taxa de crescimento e produção de escleródios.
O presente trabalho teve como objetivo realizar o levantamento, a caracterização morfológica e patogênica de isolados de S. sclerotiorum obtidos em campos de produção comercial no estado do Rio Grande do Sul.
2. MATERIAL E MÉTODOS
Os experimentos foram realizados no Laboratório de Fitopatologia da Universidade Federal de Santa Maria, campus Frederico Westphalen/RS.
2.2.1 Obtenção dos isolados
Isolados de S. sclerotiorum foram coletados em 20 diferentes campos de produção comercial contaminados do estado do Rio Grande do Sul. Após a coleta, realizada por colaboradores, as amostras (ou isolados) foram armazenados em sacos de papel (temperatura ambiente) e enviados ao Laboratório de Fitopatologia da UFSM, campus Frederico Westphalen/RS. A identificação dos isolados, as culturas de onde foram coletados, os municípios de coleta, os coletores e o ano de coleta de cada isolado estão especificados na Tabela 1.
Foram analisados 20 isolados de S. sclerotiorum provenientes de distintas cidades do estado do Rio Grande do Sul, sendo a maior parte dos isolados coletados em lavouras de soja. No entanto, também fizeram parte do estudo isolados de cultivos de nabo, canola e alface. No mapa apresentado na Figura 1, pode-se verificar a localização dos municípios onde as coletas foram realizadas.
2. MATERIAL E MÉTODOS
Os experimentos foram realizados no Laboratório de Fitopatologia da Universidade Federal de Santa Maria, campus Frederico Westphalen/RS.
2.2.1 Obtenção dos isolados
Isolados de S. sclerotiorum foram coletados em 20 diferentes campos de produção comercial contaminados do estado do Rio Grande do Sul. Após a coleta, realizada por colaboradores, as amostras (ou isolados) foram armazenados em sacos de papel (temperatura ambiente) e enviados ao Laboratório de Fitopatologia da UFSM, campus Frederico Westphalen/RS. A identificação dos isolados, as culturas de onde foram coletados, os municípios de coleta, os coletores e o ano de coleta de cada isolado estão especificados na Tabela 1.
Foram analisados 20 isolados de S. sclerotiorum provenientes de distintas cidades do estado do Rio Grande do Sul, sendo a maior parte dos isolados coletados em lavouras de soja. No entanto, também fizeram parte do estudo isolados de cultivos de nabo, canola e alface. No mapa apresentado na Figura 1, pode-se verificar a localização dos municípios onde as coletas foram realizadas.
Figura 1 – Municípios de origem dos isolados de S. sclerotiorum, segundo mapa do Rio Grande do Sul. Frederico Westphalen, RS, 2018.
Para realização das avaliações de caracterização morfológica e fisiológicas de cada isolado, os escleródios foram primeiramente desinfestados superficialmente com álcool 70% e hipoclorito de sódio 1%, ambos por 1 minuto. Posteriormente, foram enxaguados em água destilada e esterilizada. Os escleródios foram colocados no centro de placas de Petri contendo meio de cultura batata-dextrose-ágar (BDA) e incubados em BOD sob condições controladas de temperatura (18 ± 2 ºC) e fotoperíodo (12 horas).
2.2.2 Caracterização morfológica de isolados de S. sclerotiorum
A caracterização dos isolados de S. sclerotiorum foram baseadas nos parâmetros de desenvolvimento e aspecto morfológico do fungo no meio BDA.
A instalação do ensaio foi realizada com a inoculação de escleródios em placas de Petri contendo meio de cultura BDA. Inicialmente os escleródios obtidos foram desinfestados conforme item 2.1. As avaliações foram realizadas diariamente, durante um período de 30 dias, a partir da incubação dos escleródios nas placas. O delineamento experimental utilizado foi inteiramente casualizado, com quatro repetições e a unidade experimental composta por uma placa de Petri.
2.2.3 Caracterização micelial das colônias
As características avaliadas para a caracterização do micélio foram: tempo necessário para o fungo ocupar a placa de Petri (90 mm), avaliado diariamente até o fungo atingir a borda da placa de Petri; densidade do micélio formado, avaliado aos 30 dias após inoculação, classificado em 3 categorias, sendo A – abundante (quando uma espessa e uniforme camada de micélio se formou sobre o meio), R – ralo (quando apenas uma fina e homogênea camada se desenvolveu sobre o meio) ou I – irregular (quando não houve um padrão de formação do micélio sobre o meio ou entre as placas do mesmo isolado); coloração das colônias, avaliado aos 30 dias após inoculação, classificadas em 4 categorias, sendo BR – branca, BE – bege, MA – marrom ou PE – preta (CHAVES 1961; CORRADINI,1989).
2.2.4 Taxa de crescimento micelial
Foram feitas avaliações diárias do crescimento micelial por meio de medições (cm) do crescimento radial da colônia em dois eixos ortogonais, e posteriormente calculada uma média, para posterior determinação da velocidade de crescimento micelial (VCM) e índice de velocidade de crescimento micelial (IVCM).
O VCM foi determinado através da divisão da medida do crescimento final pelo número de dias que o patógeno demorou para crescer, sendo os resultados expressos em mm dia-1. Para a variável IVCM, foram analisados quatro intervalos, sendo 0 – 24, 24 – 48, 48 – 72 e 72 – 96 horas de incubação e após calculado, utilizando-se a formula adaptada de Oliveira (1991):
Sendo:
IVCM = índice de velocidade de crescimento;
D = diâmetro médio atual da colônia;
Da = diâmetro médio da colônia no dia anterior;
N = número de dias após a inoculação.
2.2.5 Caracterização dos escleródios produzidos
As características avaliadas para a caracterização dos escleródios foram: formação ou não de escleródios; tempo para formação do primeiro escleródio (dias), sendo considerado como escleródio formado o que atingiu o terceiro estádio de gênese, o qual é conhecido como maturação, ocorre delimitação de superfície, deposição de células periféricas ricas em melanina e consolidação da medula interna (TOWNSEND e WILLETTS, 1954); quantidade total de escleródios formados (contabilizado aos 30 dias após incubação); forma dos escleródios, sendo AR – arredondado, IR- irregular e DI – diversos; distribuição de escleródios na colônia, classificados em: AU – ausentes, DC – dispersos na colônia, RPM – regulares próximo a margem, em CC – círculos concêntricos e no C – centro; peso dos escleródios (gramas) após serem retirados das placas e secos a temperatura ambiente por 48 h (CHAVES, 1961; CORRADINI, 1989).
2.2.6 Caracterização patogênica de isolados de S. sclerotiorum através do método da folha destacada
Após a caracterização morfológica, os isolados foram caracterizados patogenicamente por meio da metodologia de inoculação da folha destacada (GARCIA, 2008). Para isso, sementes de soja da cultivar BMX Lança IPRO foram semeadas em vasos de 3L contendo substrato esterilizado em casa de vegetação. Quando as plantas alcançaram o estádio fenológico V4 (quarto nó) (FEHR; CAVINESS, 1977) os trifólios foram destacados da planta mãe com auxílio de uma tesoura e colocados em caixas plásticas esterilizadas contendo cinco lâminas de vidro e duas folhas de papel filtro previamente umedecidas com água destilada e esterilizada.
A escolha da cultivar BMX Lança IPRO se deu pelo fato da mesma ser muito utilizada por produtores do Rio Grande do Sul e esta apresentando a campo uma alta suceptibilidade ao mofo-branco.
Os isolados foram inoculados, colocando-se um disco de BDA, com a cultura do fungo com cinco dias de idade, sobre o centro do folíolo da folha de soja, com o micélio do fungo em contato direto com a superfície da folha. Após a inoculação, os folíolos foram mantidos a 20±2 ºC e fotoperíodo de 12 horas. Foram inoculados e avaliados quatro folíolos por isolado. O delineamento experimental utilizado foi inteiramente casualizado, com quatro repetições e a unidade experimental composta por um caixa tipo “gerbox”.
As avaliações da severidade da doença (área foliar doente) iniciaram-se 24 horas após a inoculação, com base em escala diagramática (GARCIA & JULIATTI, 2008) (Figura 2), estendendo-se até o período de 120 horas após a inoculação, tendo um intervalo entre avaliações de 24 horas.
Figura 2 – Escala diagramática de sintomas de S. sclerotiorum em folíolos de soja (Glycine max) (GARCIA, 2008), Frederico Westphalen, RS, 2018.
2.2.7 Análise estatística
Todos os dados obtidos foram submetidos a análise de variância e as médias comparadas pelo teste de Skott-Knott, a 1 % de probabilidade, pelo programa estatístico SISVAR (FERREIRA, 2000).
2.3 RESULTADOS E DISCUSSÃO
2.3.1 Caracterização morfológica de isolados de S. sclerotiorum
A análise de variância demostrou diferença significativa entre os 20 isolados de S. sclerotiorum para as variáveis referentes a caracterização morfológica. O teste de médias de Scott-Knott (p<0,1) separou os isolados em 10 grupos distintos, de acordo com o índice de velocidade de crescimento micelial (IVCM) e apresentou coeficiente de variação de 4,2% (Tabela 2).
O isolado de crescimento mais lento foi LF19 (Cidade Vacaria, cultura soja), que apresentou média de crescimento de 4,57 mm dia-1, com IVCM de 18,27. O isolado com maior crescimento foi LF08 (Cidade de Turuçu, cultura da soja) apresentou média de crescimento de 13,73 mm dia-1, tendo IVCM de 54,91 (Tabela 2). Dos isolados, 20% apresentaram crescimento diário de micélio entre 10,08 e 10,48 (Tabela 2).
Tabela 2 – Velocidade de crescimento micelial (VCM), índice de velocidade de crescimento micelial (IVCM), número e porcentagem de isolados de Sclerotinia sclerotiorum. Frederico Westphalen, RS, 2018.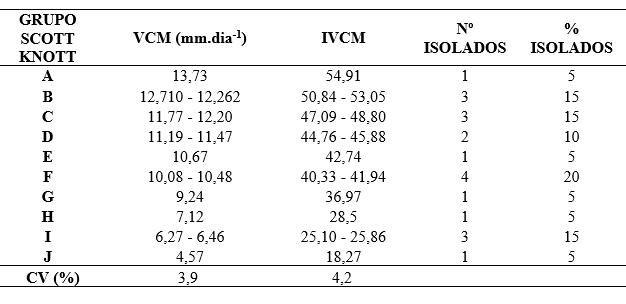
Todos os isolados avaliados completaram as placas de Petri com micélio cerca de 96 horas após incubação, corroborando com os dados de Corradini (1989), que avaliou 19 isolados de S. sclerotiorum e observou que as colônias atingiram o diâmetro máximo da placa no final de 120 horas de incubação.
As velocidades de crescimento micelial encontradas neste trabalho variaram de 13,73 a 6,09 mm dia-1. Estes valores estão abaixo dos encontrados por Abreu (2011), onde dois isolados mais lentos (UFLA 20 e UFLA 23) apresentaram média de crescimento de 14,75 mm dia-1.
Para a variável tipo de micélio produzido, 20% dos isolados apresentaram micélio abundante e 30% micélio irregular, ou seja, não houve um padrão de formação de micélio nas placas. Metade dos isolados (50%) apresentaram crescimento micelial ralo, caracterizado por uma fina camada de micélio cobrindo a superfície da placa (Figura 3). Dados similares foram obtidos por Grabicoski (2012) ao avaliar 57 isolados de S. sclerotiorum. Esta classificou o micélio em 3 tipos, sendo predominante o micélio do tipo irregular. Corradini (1989) também obteve resultados semelhantes, onde 50% dos isolados apresentaram micélio ralo.
Figura 3 – Tipos de micélio predominantes nas colônias de S. sclerotiorum em meio de cultura BDA, após 30 dias de incubação, sendo: A: abundante, B: ralo e C: irregular. Frederico Westphalen, RS, 2018.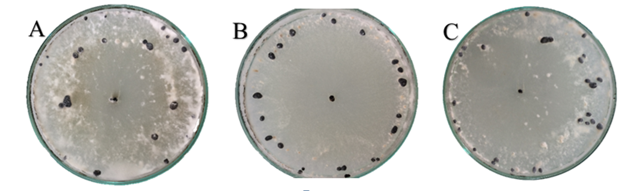
Quanto à coloração predominante nas colônias desenvolvidas sobre o meio BDA, os isolados foram caracterizados em duas categorias distintas, sendo observada coloração branca (BR) e bege (BE) (Figura 4). Dos 20 isolados avaliados, 70% (14 isolados) apresentaram coloração bege (Figura 4), corroborando com os resultados encontrados por Abreu (2011), onde maioria dos isolados apresentou coloração predominantemente bege (58%). O oposto foi encontrado por Corradini (1989), Grabicoski (2012) e Purdy (1955), que verificaram predominância de micélio branco nos isolados de S. sclerotiorum cultivados em meio BDA.
Figura 4 – Coloração predominante nas colônias de S. sclerotiorum em meio de cultura BDA, após 30 dias de incubação, sendo: A: branca e B: bege. Frederico Westphalen, RS, 2018.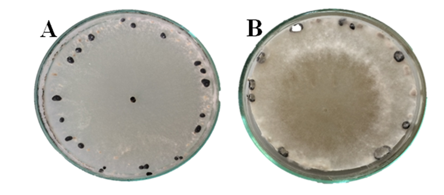
Todos os isolados analisados apresentaram produção de escleródios. A distribuição foi de 60% dos escleródios encontrados foi regulares próximos a margem da placa, 25% encontravam-se dispersos na colônia e 15% encontravam-se em círculos concêntricos (Figura 5).
Figura 5 – Distribuição de escleródios na placa das colônias de S. sclerotiorum em meio de cultura BDA, após 30 dias de incubação, sendo: A: regulares próximos a margem da placa, B: círculos concêntricos e C: dispersos na colônia. Frederico Westphalen, RS, 2018.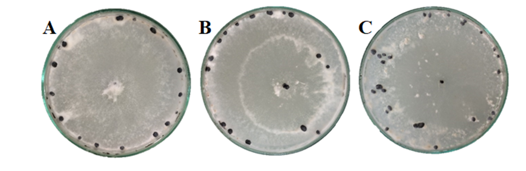
Em relação ao tempo necessário para a formação do primeiro escleródio de cada isolado, a análise de variância demonstrou que houve diferença significativa entre os isolados. O teste de médias Scott Knott (p<0,01) separou os isolados em três grupos distintos, com coeficiente de variação de 8,38% (Tabela 4). O tempo para formação de escleródios variou de 10,67 dias com os isolados LF02 (Cidade de Bagé, cultura da soja) e LF11 (Cidade de Cruz Alta, cultura do nabo), até 18 dias, com isolado LF08 (Cidade de Turuçu, cultura da soja) (Tabela 4).
Dados semelhantes foram encontrados por Grabicoski (2012), sendo que o tempo médio para a formação de escleródios variou de 11,8 a 15,4 dias. Já para Abreu (2011), o tempo para formação de escleródio nos isolados avaliados variou de 4 a 12,44 dias. Pesquisas ainda não conseguiram definir qual o tempo médio para a formação dos escleródios e se o tempo de formação influencia na agressividade dos mesmos.
O número de escleródios por placa variou de 9,67 escleródios para o isolado LF13 (Cidade Passo Fundo, cultura soja) até 28,17 para o isolado LF09 (Cidade Giruá, cultura soja), apresentando diferença significativa entre os isolados, separando os isolados em quatro grupos distintos pelo teste de médias Scott Knott (p<0,01), (Tabela 3). Os dados encontrados no trabalho apresentaram variabilidade, corrobando com trabalhos desenvolvidos por Abreu (2011), sendo que o número de escleródios variou de 10,33 a 46, e por Grabicoski (2012), variando de 16,6 a 57,2 escleródios por placa, porém o presente trabalho apresentou menor produção de escleródios.
O peso médio dos escleródios por placa variou de 0,0825 g para o isolado LF11 (Cidade Cruz Alta, cultura nabo) a até 0,2368g para o isolado LF06 (Cidade Cristal, cultura soja). A análise de variância dos pesos médios individuais dos escleródios demonstrou que houve diferença significativa entre eles, separando em quatro grupos distintos, de acordo com seu peso em gramas, apresentando coeficiente de variação de 22,18% (Tabela 3).
Tabela 3 – Número total de escleródios, tempo para formação e peso médio dos escleródios dos isolados de S. sclerotiorum. Frederico Westphalen, RS, 2018.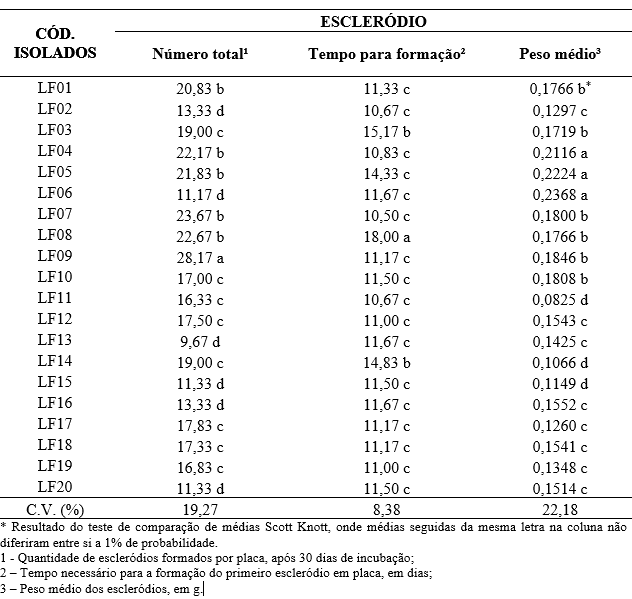
Quanto ao formato dos escleródios formados, 25% dos isolados apresentaram formato arredondado (cinco isolados), 30% formato irregular (seis isolados) e 45% apresentaram formato diverso (nove isolados). Essa variação no formato dos escleródios pode ser visualizada na Figura 6. Estes dados corroboram aos de Kreyci (2016) que verificou grande parte dos escleródios (75,3%), com formato arredondado. No entanto, divergem de Grabicoski (2012), que classificou a maioria dos isolados (65%) como diversos, com formatos variados.
Figura 6 – Formato dos escleródios formados na placa das colônias de S. sclerotiorum em meio de cultura BDA, após 30 dias de incubação, sendo: A: formato arredondado, B: formato irregular e C: formato diversos. Frederico Westphalen, RS, 2018.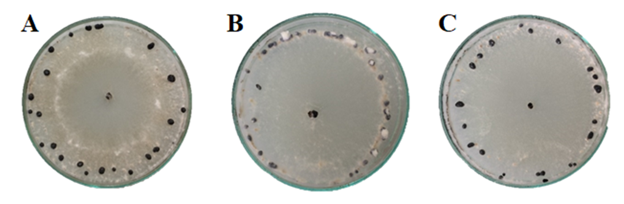
As diferenças nas taxas de crescimento micelial e a variação na coloração e no tipo de micélio podem ser atribuídas à variabilidade genética existente entre os isolados (CORRADINI, 1989; GRABICOSKI, 2012; PURDY, 1955). Em um estudo similar, Chaves (1961) avaliou as características morfológicas de diferentes isolados de S. sclerotiorum e observou que os mesmos diferiram entre si quanto a velocidade do crescimento micelial, a velocidade de formação, quantidade e tamanho dos escleródios, sugerindo a possibilidade de haver diversidade genética entre os isolados.
Contudo, o estado inicial dos escleródios utilizados nas avaliações pode ter influenciado nas características morfológicas encontradas, já que enquanto no campo, estavam sujeitos a diversas interferências ambientais (GRABICOSKI, 2012). Algumas diferenças entre a velocidade de crescimento, formação de escleródios e características morfológicas verificadas entre os isolados podem ser explicadas por vários fatores, como por exemplo, a idade (BUENO et al., 2006), a profundidade em que se encontravam no solo (escleródios na faixa de 5 a 20 cm da superfície apresentam maior tempo de sobrevivência) (AKAI, 1981; SAHARAN & MEHTA, 2008); o grau e a frequência de seca, visto que os mesmos não tem controle sobre a sua perda de água em caso de encharcamento seguido de seca, causando a perda de diversos nutrientes, e, assim, diminuindo as suas reservas (WILLETS & WONG, 1980). Estes fatores podem contribuir para o crescimento in vitro reduzido.
2.3.2 Caracterização patogênica de isolados de S. sclerotiorum
Todos os isolados avaliados provocaram lesões nos folíolos da soja. Na Tabela 4 são apresentados os resultados das avaliações a cada 24 horas, a partir de 48 horas após a inoculação (HAI) dos folíolos de soja com os distintos isolados de S. sclerotiorum.
Tabela 4 – Severidade às 48, 72, 96 e 120 horas após a inoculação (HAI) através da escala de Garcia (2008) segundo inoculação de diferentes isolados de S. sclerotiorum em folíolos de soja. Frederico Westphalen, RS, 2018.
A partir da análise de variância realizada foi possível observar diferenças significativas entre as notas médias das lesões formadas pelos isolados inoculados em folíolos de soja. Nas 48 HAI, observou-se as notas variando de 49,83 para o isolado LF02 (Cidade Bagé, cultura soja) até 0,00 para os isolados LF11 (Cidade Cruz Alta, cultura nabo), LF12 (Cidade Tapera, cultura soja), LF13 (Cidade Passo Fundo, cultura soja), LF15 (Cidade São Lourenço do Sul, cultura soja), LF19 (Cidade Vacaria, cultura soja). Outros folíolos praticamente encontravam-se sem lesões, como no caso dos folíolos inoculados com os isolados LF15 (Cidade São Lourenço do Sul, cultura soja) e LF19 (Cidade Vacaria, cultura soja), evidenciando diferenças quanto ao potencial de agressividade dos isolados estudados (Tabela 4).
Em 120 HAI, foi possível separar os isolados em quatro grupos distintos de agressividade, sendo que cada nível foi composto de cinco isolados. O nível A, considerado mais agressivo, apresentou lesões que variaram de 74,17 a 97,50 mm. O nível B apresentou lesões variando de 50 a 65,83 mm, o nível C apresentou lesões variando de 23,33 a 35 mm e o nível D, considerado o menos agressivo, apresentou lesões variando de 0,83 a 5,83 mm (Tabela 4).
Na figura 7 são demonstradas as diferenças no tamanho das lesões formadas nos folíolos de soja, segundo os quatro níveis de agressividade encontrados.
Figura 7 – Comparação entre os diferentes níveis de agressividade, de acordo com a lesão formada em folíolos de soja, após 120 horas de inoculação. Frederico Westphalen, RS, 2018.
Na figura 8 é apresentada a AACPD dos isolados provenientes de diferentes municípios do estado do Rio Grande do Sul inoculados em folíolos de soja. Observou-se que os isolados LF02 (Cidade Bagé, cultura soja), LF06 (Cidade Cristal, cultura soja), LF14 (Cidade Santa Maria, cultura da alface) e LF10 (Cidade Palmeira das Missões, cultura soja) parecem ser mais agressivos para a soja. Os isolados menos agressivos LF03 (Cidade Boa Vista das Missões, cultura soja), LF08 (Cidade Turuçu, cultura soja), LF11 (Cidade Cruz Alta, cultura nabo), LF12 (Cidade Tapera, cultura soja), LF13 (Cidade Passo Fundo, cultura soja), LF15 (Cidade São Lourenço do Sul, cultura soja) e LF19 (Cidade Vacaria, cultura soja). Diferenças na agressividade de isolados têm sido relatadas por diversos autores, em algumas culturas como a soja (KULL et al., 2004), canola (KOHLI et al., 1995) e girassol (EKINS et al., 2011; MARCIANO et al., 1983).
Figura 8 – Área Abaixo da Curva de Progresso da Doença (AACPD) de 20 isolados inoculados em soja pelo método da folha destacada. Frederico Westphalen, RS, 2018.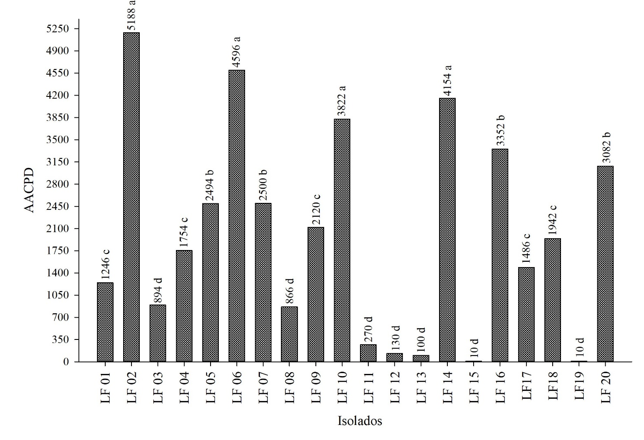
Os diferentes níveis de agressividade observados no teste da folha destacada podem estar relacionados com a capacidade de produção de ácido oxálico ou com a quantidade das enzimas que degradam a parede celular do hospedeiro (LUMSDEN, 1979; BOLTON, 2006), apresentando assim, quatro níveis diferentes de agressividade.
As populações avaliadas apresentaram ampla variabilidade para as características morfológicas e de agressividade, porém, não foi possível analisar a existência de grupos comuns que pudessem estar relacionados a origem dos isolados, devido à alta diversidade genética observada.
2.4 CONCLUSÕES
Os isolados apresentam diferentes níveis de agressividade, sendo os mais agressivos LF02 (Cidade Bagé, cultura soja), LF06 (Cidade Cristal, cultura soja), LF14 (Cidade Santa Maria, cultura da alface) e LF10 (Cidade Palmeira das Missões, cultura soja).
As populações avaliadas apresentaram ampla variabilidade para as características morfológicas, sendo predominante nas colônias micélico tipo ralo e coloração bege. Também, 60% dos escleródios dos isolados apresentaram-se regulares próximo a margem das placas e com formatos diversos.
2.5 REFERÊNCIAS BIBLIOGRÁFICAS
ABREU, G. S.; GROGN R. G. Epidemiology of diseases caused by Sclerotinia species. Phytopathology, Saint Paul, v. 69, n.8, p. 899-903, 2011.
AKAI, J, Studies on the epidemiology and control of Sclerotinia disease of beans caused by Sclerotinia sclerotiorum (Lib.) de Bary. Hokkaido Prefectural Agr. Exp. Stn. Reotr. v. 36, p. 77-79, 1981.
BOLTON, M. D.; THOMMA, B. P. H. J.; NELSON, B. D. Sclerotinia sclerotiorum (Lib.) DE Bary: biology and molecular traits of a cosmopolitan pathogen. Molecular Plant Pathology, London, v.1, n.7, p.1-16, 2006.
BUENO, C. J.; AMBRÓSIO, M. M. Q.; SOUZA, N. L. Preservação de fungos fitopatogênicos habitantes do solo. Summa Phytopathology, Botucatu, v.32, n.1, p. 42-50, 2006.
CHAVES, G. M. Estudos sobre Sclerotinia sclerotiorum (Lib) de Bary, 1961, 79f. Dissertação (mestrado). Universidade Federal de Viçosa, Viçosa, 1961.
CORRADINI, H. T. Característica em cultura pura e patogenicidade de isolados de (Sclerotinia sclerotiorum) (Lib.) de Barry, associados a soja (Glycine max (L.) Merrill) na região do Alto Paranaíba-MG. 1989. 59f. Dissertação (mestrado). Escola Superior de Agricultura de Lavras, Lavras, 1989.
DEMANT, C. A R. Mofo-branco e seu manejo no Oeste baiano. Boletim Passarela da Soja. Luis Eduardo Magalhaes, v.2, n.2, 2010. 32p.
DICKSON. Studies on Sclerotinia sclerotiorum (LIB) de Barry. 1930. Cornell. Univ., Ithaca-NY, 1930. 91p.
EKINS, M.; HAYDEN, H.; AITKEN, E.; GOULTER, K. Populations structure of Sclerotinia sclerotiorum on sunflower in Australia. Australasian Plant Pathology, Murdoch, v.40, p. 99-108, 2011.
FEHR, W. R.; CAVINESS, C. E. Stages of soybean develipment. Ames: Iowa State University, 1977. 12p. (Special Report, 80).
FERREIRA, D.F. Análises estatísticas por meio do Sisvar para Windows versão 4.0. In… REUNIÃO ANUAL DA REGIÃO BRASILEIRA DA SOCIEDADE INTERNACIONAL DE BIOMETRIA, 45, 2000. Anais… São Carlos, SP: SIB, p. 255-258, 2000.
GARCIA, R. A. Produção de inoculo, efeitos de extratos vegetais e de fungicidas e a reação de genótipos de soja a Sclerotinia sclerotiorum. 2008. 154p. Tese (Doutorado em Fitopatologia) Universidade Federal de Uberlândia, Uberlândia, 2008.
GRABICOSKI, E. M. G. Caracterização morfológica e patogênica de isolados de Sclerotinia sclerotiorum (Lib.) de Bary e detecção em sementes de soja. Dissertação (Mestrado em Agronomia – Área de Concentração: Fitopatologia). Universidade Estadual de Ponta Grossa. Ponta Grossa. 2012.
JULIATTI, F. C.; JULIATTI, F. C. Podridão branca da haste da soja: Manejo e uso de fungicidas em busca da sustentabilidade nos sistemas de produção. Uberlândia: Composer, 2010. 33p.
JULIATTI, F. C.; SANTOS, J. B.; POZZA, E.; VIEIRA, R. Sclerotinia sclerotiorum e Mofo-branco: Estudos básicos e aplicados. 2015. Disponível em https://www.researchgate.net/publication/299484987. Acesso em 06 de março de 2018.
KREYCI, P. F. Sclerotinia sclerotiorum: características morfológicas, agressividade, sensibilidade “in vitro” a fungicidas e resistência de isolados a tiofanato metílico. Tese (doutorado), Escola Superior de Agricultura Luiz de Queiroz, ESALQ, Piracicaba, 2016.
KOHLI, D. K.; BACHHAWAT, A. K. CLOURE: Clustal Output Reformatter, a program for reformatting ClustalX/ClustalW outputs for SNP analysis and molecular systematics. Nucleic Acids Research, v.31, n.13, p. 3501-3502, 2003.
KOHLI, Y.; BRUNNER, L.; YOELL, H.; MILGROOM, M.; ANDERSON, J.; MORRALL, R.; KOHN, L. Clonal dispersal and spatital mixing in populations of the plant pathogenic fungus, Sclerotionia sclerotiorum. Molecular Ecology, Oxford, v. 4, p. 69-77, 1955.
KULL, L. S.; PEDERSEN, W. L.; PALMQUIST, D.; HARTMAN, G. L. Mycelial compatibility grouping dan aggressiveness of Sclerotionia sclerotiorum. Plant Disease, Saint Paul, v. 88, p. 325-332, 2004.
LEHNER, M. S.; PAULA JUNIOR, T. J.; HORA JUNIOR, B. T.; TEIXEIRA, H.; VIEIRA, R. F.; CARNEIRO, J. E. S.; MIZUBUTI, E. S. G. Low genetic variability in Sclerotinia sclerotiorum populations from common bean fields in Minas Gerais State, Brazil, at regional, local and micro scales. Plant Pathology, Oxford, v.64, p.921-931, 2015.
LUMSDEN, R. D. Histology and physiology of pathogenesis in plan diseases caused by Sclerotinia species. Phytopathology, Lancaster, v.69, p.890-896, 1979.
MARCIANO, P.; DI LENNA, P.; MAGRO, P. Oxalic acid, cel wall-degrading enzymes and pH in pathogenesis and their significance in the virulence of two Sclerotinia sclerotiorum isolates on sunflower Physiological Plant Pathology, London, v.22, p. 339-345, 1983.
LEITE, R. M. V. B. C. Ocorrência de doenças causadas por Scleriotinia sclerotiorum em girassol e soja. Londrina: Embrapa soja, Comunicado técnico 76, 2005. 3p.
MORRAL, R. A. A.; DUCZEK, L.; SHEARD, J. W. Variations and correlations within morphology, pathogenicity, and pectolytic enzyme activity in Sclerotinia from Saskatchewan. Canadian Journal Botany, Ottawa, v.50, n10, p. 767-85, Out. 1972.
OLIVEIRA, J. A. Efeito do tratamento fungicida em sementes no controle de tombamento de plântulas de pepino (Cucumis sativus L.) e pimentão (Capsicum annum L.). 1991. 111p. Dissertação (Mestrado em Fitossanidade) – Universidade Federal de Lavras, Lavras – MG.
PARIUAD, B.; RAVIGNÉ, V.; HALKETT, F.; GOYEAU, H.; CARLIER, J.; LANNOU, C. Aggressiveness anda its role in the adaptation of plant pathogens. Plant Pathology, Oxford, v.58, p.409-424, 2009.
PURDY, L. H. A broader concepto f the species Sclerotinia sclerotiorum based on variability. Phytopathology, Saint Paul, v.45, p. 421 – 427, 1955.
REIS, E. M.; TOMAZINI, S. L. Viabilidade de esclerócios de Sclerotinia sclerotiorum em duas profundidades no solo. Summa Phytopathologica, Botucatu, v.31, p.97-99, 2005.
SAHARAN, G. S.; MEHTA. Sclerotinia Diseases of Crop Plants: Biology, Ecology and Desease Management. India: Springer, 2008.
SHANER, G.; FINNEY, R. E. The effects of nitrogen fetilization on the expression. Of slowmildwing in knox wheat. Phytopathology, Saint Paul, v.67, p.1051-1055, 1977.
SILVA, L. H. C. P.; CAMPOS, H. D.; SILVA, J. R. C. Manejo do mofo-branco da soja. In: SILVA, L. H. C. P.; CAMPOS, H. D.; SILVA, J. R. C. (Ed.). Manejo fitossanitário de cultivos agroenergéticos. Lavras: UFLA, p. 205-214, 2010.
TOWNSEND, B. B.; WILLETTS, H. J. The development of sclerotia in certain fungi. Transactions of the British Mycological Society. v. 37, p. 213-221, 1954.
WILLETS, H. J.; WONG, J. A. The biology of Sclerotinia sclerotiorum, S. trifoliorum and S. minor with emphasis on specific nomenclature. Botanical review. v. 46, p. 101-165. 1980.
Veja também: Palhada e a redução de mofo-branco
Publicação: Andréia Procedi -Equipe Mais Soja.







