Insetos conhecidos vulgarmente como corós são larvas de besouros pertencentes à família Melolonthidae (Coleoptera: Scarabaeoidea). Dentro desta família, no Brasil, são conhecidas cerca de 1.008 espécies cujas larvas vivem no solo (Morón, 2004). As larvas da maioria dessas espécies se alimentam de matéria orgânica de origem vegetal ou animal e desempenham papel importante nos ecossistemas atuando como decompositores.
No entanto, apenas cerca de 0,7% das espécies têm larvas que se alimentam de raízes e são capazes de provocar prejuízos significativos em diversas culturas de interesse econômico. No Brasil, as espécies de corós-praga que apresentam maior importância econômica são: Aegopsis bolboceridus (Thomson); Diloboderus abderus (Sturm), Liogenys fusca (Blanchard), L. suturalis Blanchard, Phyllophaga capillata (Blanchard), P. cuyabana (Moser) e P. triticophaga (Morón & Salvadori).
No Cerrado, A. bolboceridus (coró-das-hortaliças) e P. capillata (coró-da-soja-do-cerrado) (Figuras 1 e 2) são consideradas as pragas de solo mais importantes em cultivos de milho, hortaliças e soja, principalmente na região do Brasil Central. O manejo adequado dessas espécies de corós depende do mapeamento das áreas com ataque da praga por meio de amostragens de solo. Entretanto, as medidas de controle realizadas de forma preventiva são as que têm apresentado maior eficiência.
Este trabalho objetiva relatar e difundir as principais medidas de controle para o manejo de corós, baseado em estudos conduzidos na Embrapa Cerrados nos últimos 15 anos.


Manejo de Corós
Para o manejo de corós, o primeiro passo é o mapeamento dos talhões que apresentaram problemas com a praga nas safras anteriores e é nessas áreas, principalmente, que as medidas de controle devem ser aplicadas. Para as espécies de corós do Cerrado, ainda não foram determinados os níveis de dano econômico e de ação ou controle. Assim, embora seja importante realizar amostragens de solo, com a contagem das larvas, para se ter uma ideia do tamanho da população da praga, essas amostragens não poderão ser utilizadas para balizar as medidas de controle, já que os melhores resultados são obtidos com a utilização de medidas preventivas em áreas com histórico de problemas.
O conhecimento atual da bioecologia das principais espécies de corós que ocorrem no Cerrado (Oliveira; Frizzas, 2013, 2017) permite sugerir que o período-chave para adoção de medidas de controle está compreendido entre outubro e novembro, quando as chuvas começam no Cerrado e estimulam o início da atividade dos adultos. É nesse período que estão presentes no solo as larvas de primeiro instar, que são mais suscetíveis aos métodos de controle. Embora algumas práticas também possam ser adotadas fora desse período.
Medidas de controle
Plantas Inseticidas
Informações a respeito de plantas com potencial inseticida têm sido mencionadas para algumas espécies do gênero Phyllophaga Harris (Oliveira et al., 1997). Estudos conduzidos no Distrito Federal, em condições controladas (vasos), avaliaram o potencial inseticida de algumas espécies de plantas comumente utilizadas como adubo verde ou para cobertura vegetal (Tabelas 1 e 2) sobre larvas de primeiro instar de A. bolboceridus e P. capillata.
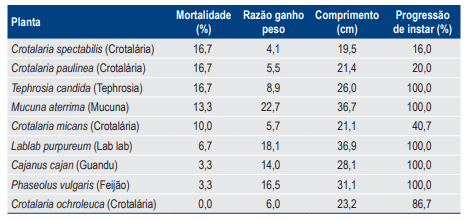
Para A. bolboceridus, os índices de mortalidade de larvas foram baixos, atingiram no máximo 16,7% com o uso de Crotalaria spectabilis Roth, C. paulinea Schrank e tephrosia. Os ganhos de peso larval foram menores para larvas presentes nos tratamentos com as quatro espécies de crotalárias (inferiores a 6 vezes) quando comparados à testemunha (feijão) (16,5 vezes). O comprimento do corpo das larvas também foi menor nos tratamentos com crotalárias. Com relação à progressão de instar (do primeiro para o segundo), observou-se que, para larvas nos tratamentos com C. spectabilis, C. paulinea e C. micans, esse índice variou entre 16% e 40,7%; para C. ochroleuca, foi de 86,7% e para as demais espécies de plantas, 100% das larvas sobreviventes atingiram o segundo instar (Tabela 1).
Tabela 1. Porcentagem de mortalidade, razão de ganho de peso, comprimento final e progressão de instar para larvas de primeiro instar de Aegopsis bolboceridus alimentadas com raízes de diversas espécies vegetais em condições de viveiro telado.
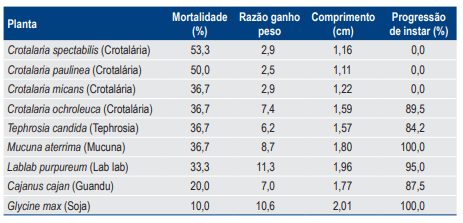
Para P. capillata, os maiores índices de mortalidade de larvas foram observados para os tratamentos com as espécies C. spectabilis (53,3%) e C. paulinea (50,0%). Com relação à razão de ganho de peso larval, observou-se que os tratamentos com C. spectabilis, C. paulinea e C. micans proporcionaram os menores índices, com valores inferiores a três vezes, enquanto a razão de ganho de peso foi de dez vezes na soja.
Com relação ao comprimento das larvas, os tratamentos com essas três espécies de planta (C. spectabilis, C. paulinea e C. micans) também proporcionaram os menores valores. Nenhuma das larvas sobreviventes que se alimentaram de C. spectabilis, C. paulinea e C. micans mudaram do primeiro para o segundo instar no período de estudo, enquanto, para as demais espécies, a porcentagem de larvas que mudaram de instar foi superior a 84% (Tabela 2).
De um modo geral, a mortalidade verificada nos tratamentos com as espécies de crotalárias sobre larvas de P. capillata foi maior do que a observada para A. bolboceridus. Entretanto, para as duas espécies de corós, observou-se efeitos negativos sobre todas as outras variáveis biológicas, principalmente para as larvas que se desenvolveram em C. spectabilis, C. paulinea e C. micans.
Assim, é possível que essas larvas, de certa forma afetadas, tenham menor potencial de sobrevivência durante o restante do ciclo biológico em função do menor peso, do comprimento e do prolongamento dos estádios larvais. Esses dados sugerem que C. spectabilis, C. paulinea e C. micans apresentam potencial para controle de larvas de corós e podem ser usadas em rotação com as culturas atacadas ou mesmo em plantios antecedendo a cultura principal como uma das estratégias de manejo dessas pragas, visando controlar as larvas no início do seu desenvolvimento biológico.
Tabela 2. Porcentagem de mortalidade, razão de ganho de peso, comprimento final e progressão de instar para larvas de primeiro instar de Phyllophaga capillata alimentadas com raízes de diversas espécies vegetais em condições de viveiro telado.
Eliminação de plantas daninhas
Estudos têm demonstrado que as fêmeas de A. bolboceridus e P. capillata, durante a revoada, escolhem plantas daninhas mais altas presentes nas áreas de cultivo para acasalar e, embaixo dessas plantas, efetuam a postura (Oliveira; Frizzas, 2013, 2017) (Tabelas 3 e 4).
Tabela 3. Número médio de ovos de Aegopsis bolboceridus, por amostra de solo (50 cm x 50 cm x 30 cm), coletados em outubro e novembro de 2005 e 2006 em Planaltina, DF em áreas com e sem a presença de vegetação.
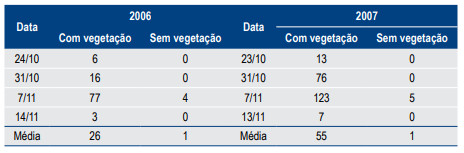
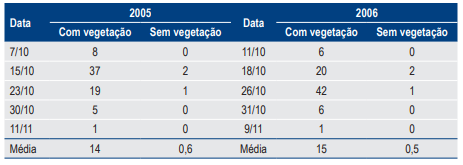 Tabela 4. Número médio de ovos de Phyllophaga capillata por amostra de solo (50 cm x 50 cm x 30 cm), coletados em outubro e novembro de 2006 e 2007 em Planaltina, DF em áreas com e sem presença de vegetação.
Tabela 4. Número médio de ovos de Phyllophaga capillata por amostra de solo (50 cm x 50 cm x 30 cm), coletados em outubro e novembro de 2006 e 2007 em Planaltina, DF em áreas com e sem presença de vegetação.
A preferência por áreas com plantas mais altas pelas fêmeas é uma estratégia que permite não só a dispersão de feromônios para localização de parceiros sexuais como também uma tentativa de aumentar a chance de sobrevivência de suas larvas, já que a postura realizada embaixo das plantas daninhas implica presença de raízes que são o recurso alimentar das larvas rizófagas (Oliveira; Frizzas, 2013).
Esse comportamento pode explicar parcialmente o padrão de ataque característico exibido pelas larvas de corós que sempre ocorre em reboleira. A concentração de ovos em determinados locais em uma área leva a uma população de larvas que irá consumir as raízes das suas plantas hospedeiras dentro desse local, levando à morte das plantas e à formação de um desenho radial com contornos irregulares (reboleiras).
Com base nessas informações, recomenda-se a eliminação das plantas daninhas mais altas, utilizando-se um implemento agrícola (por exemplo um triton), um pouco antes da revoada (agosto/setembro). Esse procedimento poderia forçar os adultos a buscarem outras áreas para acasalamento e oviposição ou fazer com que as fêmeas distribuam mais uniformemente os ovos na área, criando um “efeito de diluição” e reduzindo o fenômeno do ataque em reboleiras.
Armadilhas luminosas
Adultos de Melolonthidae, em sua maioria, são fortemente atraídos por fontes luminosas. O uso de armadilhas luminosas tem permitido obter mais de 3 mil adultos de P. capillata (Oliveira; Frizzas, 2013), em uma única noite de coleta, podendo chegar a 7 mil indivíduos (Oliveira, C. M. dados não publicados). Considerando-se que metade desses indivíduos sejam fêmeas e que cada uma possa colocar em média 20 ovos, essas armadilhas poderiam evitar a postura de cerca de 30 mil a 70 mil ovos por noite.
Assim, em talhões onde há histórico de ataque de corós, recomenda-se a utilização de armadilhas luminosas para a coleta e a eliminação dos adultos. Nessas armadilhas, pode-se utilizar lâmpadas comuns ligadas a baterias automotivas, presas em suportes de metal ou madeira, colocando-se embaixo recipientes (bacias) contendo água com detergente ou óleo para a coleta dos adultos. Essa prática pode ser adotada entre os meses de setembro e outubro, podendo estender-se até novembro, em função do início das chuvas, período em que os adultos são ativos.
Controle biológico
Agentes para o controle biológico de A. bolboceridus e P. capillata têm sido estudados de forma preliminar no Brasil.
Fungos entomopatogênicos
Foram realizados estudos com populações A. bolboceridus para verificar a ocorrência natural de fungos entomopatogênicos. Adultos foram coletados em Luziânia, GO, na safra 2010/2011, em área de produção de milho e mantidos em quarentena em laboratório. Foram obtidos dois isolados de Metarhizium com índice de ocorrência de 0,5% na população. Desses isolados, identificou-se a presença de Metarhizium lepidiotae (Driver; Milner) sendo este o primeiro registro desse fungo infectando um inseto no Brasil (Lopes et al., 2013). Para P. capillata, estudos de campo revelaram a prevalência de M. anisopliae (Metsch.), que foi registrado em 0,51% dos adultos coletados em armadilhas luminosas. Bioensaios de laboratório, com larvas e adultos, registraram mortalidades inferiores a 5,6%, indicando baixo potencial do uso de isolados de Metarhizium em populações de P. capillata (Lopes et al., 2013).
Nematoides entomopatogênicos
Estudos de prospecção da ocorrência de nematoides entomopatogênicos foram conduzidos no Distrito Federal e Goiás. Larvas de terceiro instar de A. bolboceridus e P. capillata foram coletadas em áreas de cultivo de hortaliças, de milho e de soja e mantidas em quarentena em laboratório e os espécimes que apresentavam algum sintoma de infecção por agentes entomopatogênicos foram separados. Larvas de A. bolboceridus, coletadas em milho em Luziânia, GO (2009), em hortaliças em Brazlândia, DF (2011) e em soja em Planaltina, DF (2018) e larvas de P. capillata coletadas em soja em Planaltina, DF (2018), apresentaram altos índices de infecção por nematoides entomopatogênicos. Nas áreas localizadas em Luziânia, GO e em Brazlândia, DF, observou-se a redução drástica das populações de corós nas safras seguintes, sugerindo que esses agentes de controle biológico têm grande potencial de uso para o controle de populações de corós. Os nematoides entomopatogênicos obtidos nessas coletas estão em fase de identificação taxonômica no Instituto Biológico de Campinas.
Preparo do solo
Os dados de pesquisa a respeito da eficiência do preparo do solo como forma de controlar corós são inconclusivos. Entretanto, a experiência tem mostrado que as maiores chances de sucesso dependem da época em que essa prática é adotada. No Cerrado, entre outubro e março, as larvas de A. bolboceridus e de P. capillata estão ativas (se movimentando e se alimentando).
Nessa época, é pouco provável que o preparo do solo tem efeito sobre as populações de corós pois as larvas dessas espécies, ao serem expostas pelo implemento, são capazes de retornar rapidamente ao interior do solo. A recomendação de utilização dessa prática seria no final do período chuvoso (abril/maio), em que o solo ainda possui umidade suficiente para a entrada dos implementos e os insetos estariam em fase de pré-pupa ou como larvas com baixa mobilidade.
Nessas condições, os insetos não seriam capazes de retornar ao interior do solo ficando expostos a condições climáticas desfavoráveis, como a incidência direta de raios solares, e também ficariam expostos a predadores, como formigas, aves, tatus e outros pequenos animais. Ressalta-se, no entanto, que essa prática não é recomendada para áreas que adotam o sistema de plantio direto (Oliveira et al., 1997; 2000).
Data de semeadura e outras medidas que promovam o crescimento radicular
Em propriedades extensas, recomenda-se semear primeiro os talhões com histórico de ataque de corós. Essa prática cria condições para que as plantas se desenvolvam na presença de larvas menores, que são menos vorazes e que tenham disponíveis uma quantidade razoável de raízes na época em que as larvas estiverem maiores (terceiro instar), suportando melhor o ataque. Outras medidas que promovam condições adequadas para o rápido crescimento radicular tais como, adubação adequada e correção da acidez do solo, inoculação com bactérias fixadoras de nitrogênio e eliminação de camadas compactadas (Oliveira et al., 1997), são recomendadas para aumentar a capacidade das plantas de suportarem o ataque da praga.
Considerações finais
Para o manejo de corós, é de grande importância que se saiba reconhecer as espécies que são pragas em cada região. Além disso, deve-se diferenciar as larvas das espécies-praga daquelas que se alimentam apenas de matéria orgânica e que são organismos benéficos. Outro ponto importante é que nenhuma das medidas de controle citadas acima é altamente eficiente quando usada de forma isolada. Assim, é importante que os produtores procurem adotar as diversas práticas disponíveis de forma a conviver com as populações da praga, minimizando seus prejuízos. Por fim, o controle químico dessas espécies de corós que ocorrem no Cerrado (A. bolboceridus e P. capillata) não pode ser recomendado em função da inexistência de inseticidas registrados no Ministério da Agricultura, Pecuária e Abastecimento (Mapa) para o controle dessas pragas.
Autor: Charles Martins de Oliveira, engenheiro-agrônomo, doutor em Entomologia, pesquisador da Embrapa Cerrados, Planaltina, DF.
Referências
LOPES, R. B.; SOUZA, D. A.; OLIVEIRA, C. M.; FARIA, M. Genetic diversity and pathogenicity of Metarhizium spp. associated with the white grub Phyllophaga capillata (Blanchard) (Coleoptera: Melolonthidae) in a soybean field. Neotropical Entomology, v. 42, n. 4, p. 436- 438, 2013.
MORÓN, M. A. Melolontídeos edafícolas. In: SALVADORI, J. R.; ÁVILA, C. J.; SILVA, M. T. B. (Ed.). Pragas de solo no Brasil. Passo Fundo: Embrapa Trigo, 2004. p. 133-166.
OLIVEIRA, C. M.; FRIZZAS, M. R. Field biology of the beetle Aegopsis bolboceridus in Brazil, with a list of host plant. Journal of Insect Science, v. 13, n. 48, 2013. Disponível em: <https:// doi.org/10.1673/031.013.4801>. Acesso em: 04 dez. 2018.
OLIVEIRA, C. M.; FRIZZAS, M. R. How climate influences the biology and behaviour of Phyllophaga capillata (Coleoptera: Melolonthidae) in the Brazilian Cerrado. Austral Entomology, 2017. Disponível em : <https://doi.org/10.1111/aen.12309>. Acesso em: 04 dez. 2018.
OLIVEIRA, L. J.; HOFFMANN-CAMPO, C. B.; GARCIA, M. A. Effect of soil management on the white grub population and damage in soybean. Pesquisa Agropecuária Brasileira, v. 35, n. 5, p. 887-894, 2000.
OLIVEIRA, L. J.; GARCIA, M. A.; HOFFMAN-CAMPO, C. B.; SOSA-GOMEZ, D. R.; FARIAS, J. R. B.; CORSO, I. C. Coró-da-soja Phyllophaga cuyabana. Londrina: EMBRAPA-CNPSO, 1997. 30 p. (EMBRAPA-CNPSO, Circular Técnica, 20).
Fonte: Embrapa