A canola (Brassica napus L. var oleífera) é uma cultura oleaginosa da família das crucíferas que possui importância mundial por ser uma fonte de óleo e proteína para a alimentação humana e animal. Além dos desafios operacionais e ecofisiológicos no cultivo da canola, outro fator importante a se considerar são os problemas fitossanitários que podem comprometer a produtividade da cultura, como as pragas, plantas daninhas e doenças.
A bactéria Xanthomonas campestris pv. campestris (Pammel) Downson é o agente causal da podridão negra das crucíferas, considerada a doença de maior importância de espécies como Brassica oleracea L., que abrange variedades de repolho, couve-flor e brócolis e B. napus L. var oleífera, sendo a canola (MARINGONI & SILVA JÚNIOR, 2016). A doença está presente na grande maioria das áreas que recebem o cultivo de plantas da família das crucíferas, onde a maior severidade é notada em regiões com prevalência de clima tropical e subtropical.
A principal forma de disseminação de X. campestris pv. campestris está relacionada a sementes contaminadas, com a presença do patógeno no exterior e interior das sementes, na região do folículo, podendo permanecer viável dessa forma por até 3 anos (Figura 1) (GITAITIS & WALCOTT, 2007). A manutenção do patógeno na lavoura pode ocorrer via plantas da mesma família cultivadas e/ou daninhas presentes na área, como o nabo-forrageiro (Raphanus sativus) e a nabiça (Raphanus raphanistrum), pela manutenção de plantas guaxas de canola na entressafra e pela presença de restos culturais dessas espécies na área.
Figura 1. Ciclo de Xanthomonas campestris pv. campestris em crucíferas. Adaptado de: (AN et al., 2020).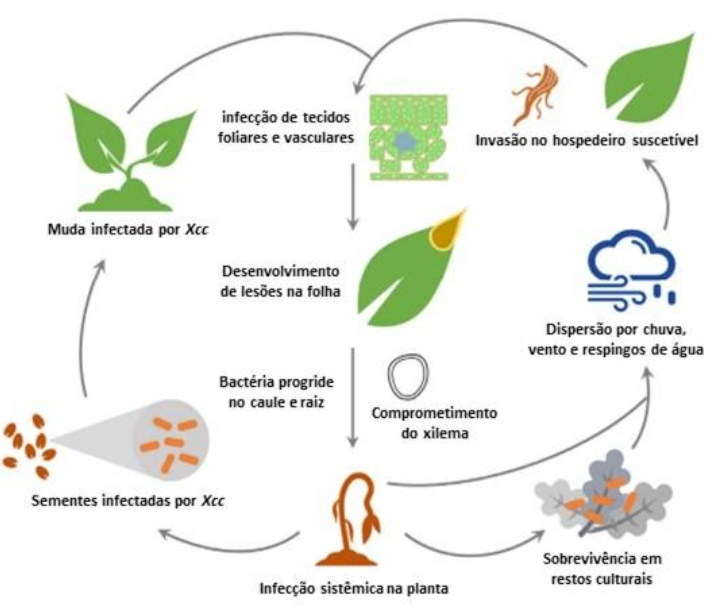
A condição ideal para o estabelecimento da infecção em plantas suscetíveis são a presença de temperaturas acima de 25 ºC e alta umidade do ambiente, principalmente com a disponibilidade de água livre na superfície das folhas, devido a necessidade de água para que ocorre a movimentação do patógeno (CHRISTIANO et al., 2009). O processo de gutação que ocorre durante a noite, e com alta umidade do ambiente, as plantas mantêm os estômatos e hidatódios abertos para que ocorra a homeostase da água, onde a planta se torna altamente suscetível a infecção de X. campestris pv. campestris (SINGH, 2013).
O início da infecção ocorre com o crescimento da bactéria na superfície exterior das folhas, onde posteriormente a entrada na planta ocorre via aberturas naturais, principalmente pelos hidatódios, ou por ferimentos causados por ventos, granizo, insetos, entre outros (RUDOLPH et al., 1994). Com a entrada da bactéria na planta, ocorre o desenvolvimento sistêmico do patógeno através do xilema e do parênquima mesofílico, resultando no desenvolvimento de sintomas da doença (RYAN et al., 2011).
Os principais sintomas de podridão negra quando a infecção ocorre pelos hidatódios se caracterizam por lesões com halo amarelo nas margens das folhas em formato de “V” acompanhado do escurecimento vascular (Figura 2), sendo que com o avanço da doença os tecidos afetados necrosam, podendo causar a abscisão foliar (WILLIAMS, 1980). A presença de lesões alongadas com tecidos necróticos e halos amarelecidos podem ser observadas no limbo foliar, estando relacionadas a penetração da bactéria pelos estômatos, onde o desenvolvimento de infecções secundárias podem resultar em apodrecimento das plantas (MARINGONI & SILVA JÚNIOR, 2016). Os sintomas podem ocorrer de maneira mais acentuada em pontos da lavoura que sofrem maior dano na área foliar, como nos rastros de amassamento dos maquinários, onde o monitoramento desses pontos pode facilitar a detecção da doença.
Figura 2. Sintomas em “V” na folha de couve atacada pelo mesmo patógeno, Xanthomonas campestris pv. campestris. Adaptado de Gerald Holmes, Strawberry Center, Cal Poly San Luis Obispo, Bugwood.org.

O manejo de X. campestris pv. campestris na cultura da canola deve ser realizado preventivamente a ocorrência da infecção das plantas, visto a dificuldade de manejar a doença quando as plantas já foram infectadas. O uso de sementes livres do patógeno é o método mais eficiente para impedir a entrada de inóculo em áreas onde a presença da doença ainda não foi reportada. A rotação de culturas, onde o cultivo de canola ou outras culturas da família das crucíferas não são realizados por pelo menos duas safras é uma importante estratégia de manejo para redução de inóculo em áreas com a presença do patógeno, assim como, o controle de plantas guaxas de canola, visto a especificidade da bactéria por hospedeiros.
Sobre os autores:
Luiz Eduardo Braga e Eduardo Argenta Steinhaus = Estudante do curso de agronomia URI Campus Santo Ângelo e membro do Grupo de Proteção de Plantas URI Santo Ângelo.
Marcelo Gripa Madalosso = Professor Dr. da URI Campus Santo Ângelo e Santiago e coordenador do grupo de proteção de plantas URI Santo Ângelo e Santiago.

Referências
CHRISTIANO, R. S. C.; DALLA PRIA, M.; JESUS JUNIOR, W. C. et al. Modelling the progress of Asiatic citrus canker on Tahiti lime in relation to temperature and leaf wetness. Eur J Plant Pathol. 124:1–7. 2009.
GITAITIS R.; WALCOTT R. The epidemiology and management of seedborne bacterial diseases. Annu Rev Phytopathol. 45:371–97. 2007.
MARINGONI, A. C.; SILVA JÚNIOR, T. A. F. Doenças das Brássicas. In: AMORIM, L. et al. (ed.). Manual de Fitopatologia: doenças das plantas cultivadas. 5. ed. Ouro Fino: Agronômica Ceres, 2016. v. 2, cap. 19, p. 165-173.
RUDOLPH, K.W.E.M.; GROSS, F.; EBRAHIM-NESBAT, M.; NÖLLENBURG, A.; ZOMORODIAN, K.; WYDRA, M.; NEUGEBAUER, U.; HETTWER, W.; EL-SHOUNY, B.; SONNENBERG & Z. KLEMENT. The role of extracellular polysaccharides as virulence factors for phytopathogenic pseudomonads and xanthomonads. In: Kado, C.I. and Crosa, J.H. (eds). Molecular mechanisms of bacterial virulence. pp. 357-378. Kluwer, Dordrecht, the Netherlands. 1994.
RYAN, R. P.; VORHOLTER, F. J.; POTNIS, N. et al. Pathogenomics of Xanthomonas: understanding bacterium-plant interactions. Nat Rev Microbiol. 9:344–55. 2011.
SINGH, S. Guttation: quantification, microbiology and implications for phytopathology. Progress in Botany 75:187. 2013.
WILLIAMS, P. H. Black rot: a continuing threat to world crucifers. Plant Disease, Saint Paul, v. 64, n. 8, p. 736-742, 1980.



