A mancha-alvo na cultura da soja é causada pelo fungo Corynespora cassiicola. Os sintomas típicos da doença são observados nas folhas, iniciando por pontuações pardas, com halo amarelado e evoluindo para manchas circulares, de coloração castanho-clara a castanho-escura. Normalmente, as manchas apresentam pontuação no centro e anéis concêntricos de coloração mais escura. Também podem ocorrer manchas em pecíolos, hastes e vagens.
A infecção é favorecida por alta umidade relativa. Cultivares suscetíveis podem sofrer desfolha com perdas de até 40% de produtividade (Godoy et al., 2016). Além da soja, o fungo infecta mais de 400 espécies de plantas (Farr; Rossman, 2019), entre elas importantes culturas como o algodão, o mamão, a seringueira, o tomate, o feijão, a crotalária e diversas plantas daninhas.
Apesar de testes de inoculações cruzadas mostrarem que isolados são mais agressivos quando inoculados no hospedeiro de origem, indicando evidências de especialização, isolados obtidos de soja e algodão no Brasil infectam ambas as culturas (Galbieri et al., 2014). Além da ampla gama de hospedeiros, o fungo pode sobreviver em sementes infectadas e em restos de cultura e formar clamidósporos que são estruturas de sobrevivência (Oliveira et al., 2012).
A incidência dessa doença tem aumentado na cultura da soja nas últimas safras em razão do aumento da semeadura de cultivares suscetíveis, da utilização de culturas em sucessão que são hospedeiras do fungo, como o algodão e a crotalária, e da menor sensibilidade/resistência do fungo a fungicidas. Isolados do fungo com mutações de ponto que conferem menor sensibilidade a fungicidas já foram relatados para metil benzimidazol carbamato (MBC), inibidores da quinona externa (IQe) e inibidores da succinato desidrogenase (ISDH) (FRAC, 2019; Mello, 2019).
As estratégias de manejo recomendadas para essa doença são: a utilização de cultivares resistentes/ tolerantes, o tratamento de sementes, a rotação/sucessão de culturas com milho e outras espécies de gramíneas e o controle químico com fungicidas (Godoy et al., 2016).
Desde a safra 2011/12, experimentos em rede vêm sendo realizados para a comparação da eficiência de fungicidas registrados e em fase de registro para o controle da mancha-alvo na cultura da soja. O objetivo dos experimentos em rede é a avaliação da eficiência de controle no alvo biológico. Para isso são utilizadas aplicações sequenciais de fungicidas. No entanto, isso não constitui uma recomendação de controle.
As informações devem ser utilizadas dentro de um sistema de manejo, priorizando sempre a rotação de fungicidas com diferentes modos de ação para atrasar o aparecimento de resistência do fungo aos fungicidas. O objetivo deste trabalho foi avaliar a eficiência de fungicidas para o controle da mancha-alvo na cultura da soja na safra 2018/19.
Material e Métodos
Foram instalados 23 experimentos na safra 2018/19 por 15 instituições (Tabela 1). A lista de tratamentos (Tabela 2), o delineamento experimental e as avaliações foram definidos por protocolo único, permitindo a sumarização conjunta dos experimentos. Os fungicidas utilizados nos tratamentos 3 a 5 apresentam registro no Ministério da Agricultura Pecuária e Abastecimento (MAPA), para o controle da mancha-alvo em soja, e os fungicidas dos tratamentos 1, 6 a 10 apresentam Registro Especial Temporário III (RET III).
Os fungicidas avaliados pertencem aos grupos: metil benzimidazol carbamato – MBC (carbendazim), inibidores da desmetilação – IDM (protioconazol, epoxiconazol, ciproconazol, difenoconazol e tebuconazol), inibidores de quinona externa – IQe (trifloxistrobina, piraclostrobina, dimoxistrobina e azoxistrobina), inibidores da succinato desidrogenase – ISDH (fluxapiroxade, bixafen e boscalida), ditiocarbamato (mancozebe), inorgânico (oxicloreto de cobre) e cloronitrila (clorotalonil). Foram avaliados fungicidas formulados em misturas duplas e triplas dos grupos: IQe + ISDH (T5), IDM + IQe + ISDH (T3 e T4), ISDH + IDM (T6 e T8), IQe + IDM + ditiocarbamatos (T9) e ISDH + inorgânico (T7).
Também foram avaliados fungicidas compostos por um único ingrediente ativo, como o carbendazim (MBC – T2) e o clorotalonil (cloronitrila – T10).

O delineamento experimental foi blocos ao acaso com quatro ou cinco repetições, sendo cada repetição constituída de parcelas com, no mínimo, seis linhas de cinco metros. As aplicações iniciaram-se no préfechamento das linhas, aos 47 dias (± 4 dias) após a semeadura. O intervalo entre a primeira e a segunda aplicação foi de 16 dias (± 3 dias), entre a segunda e a terceira aplicação foi de 15 dias (± 1 dia) e entre a terceira e a quarta aplicação (11 ensaios) foi de 14 dias (± 1 dia). Para a aplicação dos produtos foi utilizado pulverizador costal pressurizado com CO2 e volume de aplicação mínimo de 120 L ha-1
Foram utilizadas cultivares consideradas suscetíveis à mancha-alvo, com base em observações a campo. As áreas para instalação dos ensaios foram semeadas no início da época recomendada, para reduzir a probabilidade de incidência da ferrugem-asiática. Em situações onde ocorreu ferrugem foram realizadas aplicações de picoxistrobina + ciproconazol 60 g + 24 g i.a. ha-1 (Aproach® Prima, DuPont) + Nimbus 0,75 L ha-1, em área total do experimento.
Foram realizadas avaliações da severidade da mancha-alvo após a última aplicação, da severidade de outras doenças, da produtividade em área mínima de 5 m2 centrais de cada parcela e do peso de 1000 grãos. Para a análise conjunta, foram utilizadas as avaliações da severidade da mancha-alvo, realizadas entre os estádios fenológicos R5 (início de enchimento de grãos) e R6 (vagens com 100% de granação) e da produtividade.
O intervalo médio entre a terceira ou quarta aplicação e a avaliação da severidade utilizada na análise dos ensaios foi de 15 dias (± 7 dias). Foram realizadas análises de exploratórias de variância, para cada local. A produtividade dos experimentos onde houve incidência de ferrugem foi eliminada da análise conjunta.
As análises conjuntas de severidade e da produtividade foram realizadas utilizando-se técnicas de modelos lineares generalizados mistos, os quais permitem a adoção de distribuições não-normais e a acomodação dos efeitos das interações entre locais e tratamentos por meio de alterações na estrutura da matriz de variâncias e covariâncias. Para identificar todos os tratamentos com prováveis efeitos semelhantes, foi utilizado o teste de comparações múltiplas de Tukey (p≤0,05).
Todos os modelos investigados foram obtidos usando-se o procedimento glimmix, em rotinas implementadas no sistema SAS/STAT® software, Versão 9.4. Copyright© 2016 SAS Institute Inc.
Resultados
Os experimentos dos locais 3, 17, 18 e 23 (Tabela 1) não tiveram doença ou tiveram baixa severidade, sem diferenciação de tratamentos, sendo eliminados das análises. Além desses locais, a variável produtividade dos locais 5, 6, 9, 10, 11, 13, 16, 19 e 22 foi eliminada em razão da incidência de ferrugem ou seca, que interferiu na produtividade dos tratamentos. Para as análises estatísticas conjuntas da variável severidade foram utilizados os resultados dos experimentos dos locais: 1, 2, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 19, 20, 21 e 22 (19 locais) e para a variável produtividade os experimentos dos locais: 1, 2, 4, 7, 8, 12, 14, 15, 20 e 21 (10 locais) (Tabela 1).
As menores severidades e as maiores porcentagens de controle foram observadas nos tratamentos com fluxapiroxade + protioconazol (T6 – 80%) e bixafen + protioconazol + trifloxistrobina (T3 – 79%) seguido de piraclostrobina + epoxiconazol + fluxapiroxade (T4 –
67%) e azoxistrobina + tebuconazol + mancozebe (T9 – 67%) (Tabela 3). O tratamento com fungicida multissítio isolado, clorotalonil (T10) apresentou eficiência semelhante à dimoxistrobina + boscalida (T5), com controle de 52% e 53%, respectivamente.
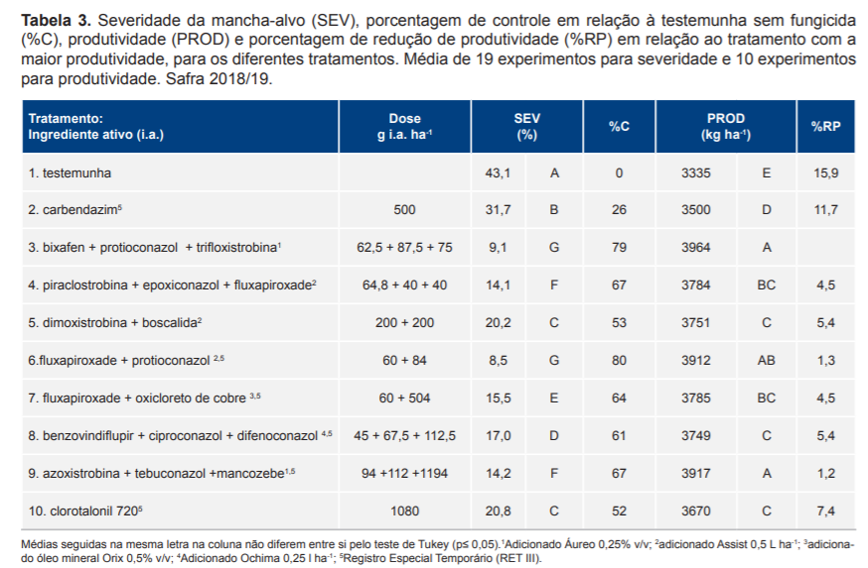
A menor porcentagem de controle foi observada para o tratamento com carbendazim (T2 – 26%), superior à testemunha sem fungicida, confirmando a menor sensibilidade do fungo a fungicidas MBC. A baixa eficiência de controle da doença com fungicidas MBC vem sendo observada nos ensaios em rede desde 2012/13. Os fungicidas comerciais desse grupo atuam inibindo a montagem dos microtúbulos do fuso durante a divisão nuclear ligando-se à proteína β-tubulina (Ma; Michailides, 2005). Populações resistentes podem apresentar mutações na proteína β-tubulina.
As mutações de ponto E198A e F200Y no gene da β-tubulina, que conferem resistência completa foram encontradas em isolados de C. cassiicola obtidos de folhas de soja de plantas coletadas no Mato Grosso, no Paraná e no Mato Grosso do Sul (Mello, 2009), o que
pode explicar a baixa eficiência desse fungicida.
As maiores produtividades foram observadas para os tratamentos com bixafen + protioconazol + trifloxistrobina (T3 – 3964 kg ha-1), azoxistrobina + tebuconazol + mancozebe (T9 – 3917 kg ha-1) e fluxapiroxade + protioconazol (T6 – 3912 kg ha-1) (Tabela 3).
A média da redução de produtividade da testemunha sem fungicida em relação a maior produtividade (T3) foi de 15,9%. Apesar do número diferente de experimentos utilizados na sumarização das variáveis severidade e produtividade, a correlação (r) entre as variáveis foi de r=-0,98.
A utilização de fungicidas é uma das ferramentas de controle. Entretanto relatos de resistência do fungo a fungicidas vêm aumentando. A mutação G143A, que confere resistência completa a fungicidas IQe foi detectada em número significativo de amostras no
Brasil em 2015 e 2016 em isolados de C. cassiicola no Mato Grosso, no Mato Grosso do Sul e no Paraná (FRAC, 2019; Mello, 2019). Em 2017/2018 isolados com as mutações sdhB-H278Y e sdhC-N75S que conferem menor sensibilidade do fungo a fungicidas ISDH foram relatadas pelo FRAC (2018).
Os relatos de resistência reforçam a necessidade de adoção de estratégias antirresistência e a utilização de todas as estratégias no manejo da doença, tais como a utilização de cultivares resistentes/ tolerantes, o tratamento de sementes e a rotação/diversificação de culturas com milho e/ou outras espécies de gramíneas.
Referências
FRAC. Fungicide Resistance Action Committee – FRAC. Minutes of the 2019 QoI Working Group. Brussels, Belgium: FRAC, 2019. Disponível em: <https://www.frac.info/working-group/qoi-fungicides>. Acesso em: 9 jul. 2019.
FRAC. Comitê de Ação a Resistência a Fungicidas – FRAC – Brasil. Informação preliminar sobre carboxamidas para mancha alvo. Holambra, SP: FRAC, 2018. Disponível em: <https://docs.wixstatic. com/ugd/85b1d3_75c39b4ea047493bb3614c807ce38266.pdf>. Acesso em: 9 jul. 2019.
FARR, D.F.; ROSSMAN, A.Y. Fungal databases, U.S. National Fungus Collections, ARS, USDA. Disponível em: < https://nt.ars-grin. gov/fungaldatabases/>. Acesso em: 9 jun. 2019.
GALBIERI, R., ARAÚJO, D.C.E.B., KOBAYASTI, L., GIROTTO, L., MATOS, J.N., MARANGONI, M.S., ALMEIDA, W.P., MEHTA, Y.R. Corynespora leaf blight of cotton in Brazil and its management. American Journal of Plant Sciences, v. 5, p. 3805-3811, 2014.
GODOY, C.V.; ALMEIDA, A.M.R.; COSTAMILAN, L.M.; MEYER, M.C; DIAS, W.P.; SEIXAS, C.D.S.; SOARES, R.M.; HENNING, A.A.; YORINORI, J.T.; FERREIRA, L.P.; SILVA, J.F.V.; Doenças da soja. In: AMORIM, L.; REZENDE, J.A.M.; BERGAMIN FILHO, A.; CAMARGO, L.E.A. (Org.). Manual de Fitopatologia: v. 2. Doenças das plantas cultivadas. 5. ed. São Paulo: Ceres, 2016. p. 657- 675.
MA, Z.; MICHAILIDES, T.J. Advances in understanding molecular mechanisms of fungicide resistance and molecular detection of resistant genotypes in phytopathogenic fungi. Crop Protection, v. 24, n. 10, p. 853-863, 2005.
MELLO, F. E. Variabilidade genética e sensibilidade de Cercospora kikuchii, Colletotrichum truncatum e Corynespora cassiicola a fungicidas. 2019. 232 f. Tese (Doutorado em Agronomia) – Universidade Estadual de Londrina, Londrina.
OLIVEIRA, R.R.; AGUIAR, B.D.M.; TESSMANN, D.J.; PUJADERENAUD, V.; VIDA, J.B. 2012. Chlamydospore formation by Corynespora cassiicola. Tropical Plant Pathology, v. 37, n. 6, p. 415-418, 2012.
Fonte: Embrapa





