O capim-amargoso (Digitaria insularis) (Tabela 1) é uma planta nativa das regiões tropicais e subtropicais da América, encontrada do sul dos Estados Unidos até o norte das planícies dos Pampas, na Argentina. No Brasil, ocorre com grande intensidade nas regiões Sudeste, Centro-Oeste e Nordeste. Espécie com grande agressividade e rusticidade, que ocupa os mais diversos sistemas produtivos. Gramínea perene, entouceirada, rizomatosa e que se desenvolve em áreas cultivadas, de pastagens, terras abandonadas, terrenos baldios e margens de rodovias. Possui alta dispersão, podendo gerar mais de 50 mil sementes durante o ano, facilmente dispersas pelo vento e colhedoras.
Interferência em cultivos
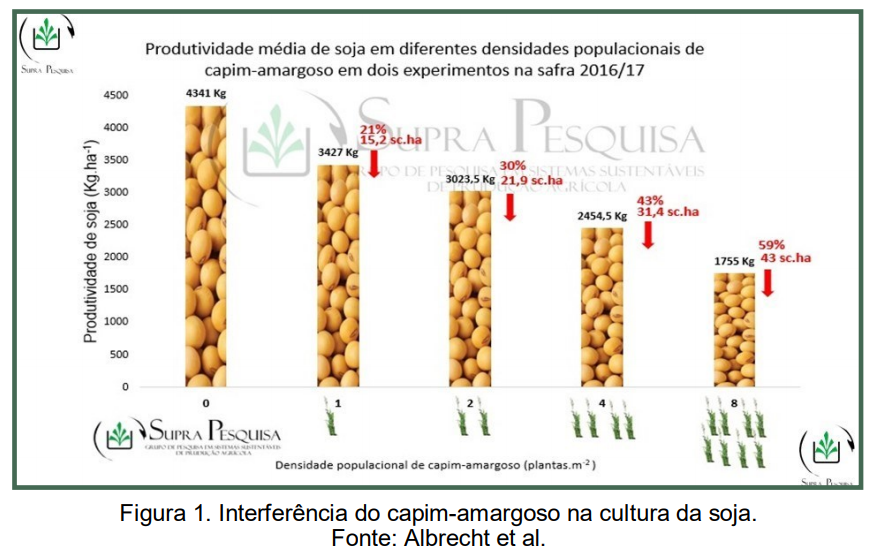
Gemelli et al. (2013) destaca que com a inserção do sistema plantio direto a espécie cresceu sua importância na agricultura brasileira, em consequência das suas características agressivas como a formação de touceiras, rizomas e a disseminação de propágulos, uma vez que a planta se estabelece com o início da formação dos rizomas e posterior formação de grandes touceiras, tornando-se de difícil controle. A convivência de 8 plantas m2 com a cultura da soja já é suficiente para reduzir a produtividade em 80% (Gazziero et al., 2019). Observações de campo mostram que uma planta de capim-amargoso por metro quadrado pode levar a perdas estimadas de um quinto da lavoura de soja, aproximadamente (Figura 1).
Casos de resistência aos herbicidas
A repetida utilização dos herbicidas com o mesmo mecanismo de ação, nos últimos anos, tem causado à pressão de seleção em algumas espécies de plantas daninhas, com consequente surgimento de populações resistentes. O primeiro caso de resistência de capim-amargoso foi registrado no Paraguai no ano de 2005, ao herbicida glifosato. No Brasil, a resistência de capim-amargoso ao herbicida glifosato foi registrada pela primeira vez no ano de 2008, no estado do Paraná. Em 2016, na região Centro Oeste do país, foi registrado resistência de capim-amargoso aos herbicidas inibidores da ACCase, como fenoxaprope e haloxifope (Heap, 2020). Mais recentemente, foi relatado biótipo resistente, no estado do Mato Grosso, resistente ao haloxifope e pinoxadem (Takano et al., 2020). Mais detalhes sobre os casos são apresentados na Tabela 2 e situação de campo indicada na Figura 2.
Opções de manejo
Existem várias práticas para o manejo de capim-amargoso resistente ao glifosato as quais são: dessecação na fase inicial de desenvolvimento para evitar que as plantas controladas não produzam sementes, rotação de mecanismos de ação e grupos químicos, além de outras práticas agrícolas como limpeza das máquinas e colhedoras a pós-colheita, capina, rotação de culturas, roçada, plantas de cobertura, novos cultivos transgênicos, etc. Ainda em relação a dessecação, esta deve ser feita com boa antecedência ao plantio e quando necessário complementar a aplicação com outros produtos (Oliveira Júnior et al., 2006; Canedo et al., 2019). A dessecação imediatamente anterior à semeadura envolve a aplicação de um ou mais herbicidas (normalmente de ação sistêmica) para o manejo, que em função da composição florística da área e da densidade de infestação é feita a escolha do produto ou produtos a serem utilizados na área (Oliveira Júnior et al., 2006). Há uma necessidade contínua de busca de soluções para essa espécie de difícil manejo (como ilustrado pelos experimentos a campo na Figura 3).
Em pesquisa com inibidores da ACCase, Cassol et al. (2019) observaram eficácia equivalente para cletodim e haloxifope, em associação com glifosato, no controle de capim-amargoso perenizado em pós-emergência da soja, mas no controle das plantas na entressafra, cletodim + glifosato foi superior a haloxifope + glifosato. Zobiole et al. (2016) não observaram diferenças no controle, na comparação entre cletodim e haloxifope, em associações com glyphosate.
Outros estudos destacam a eficácia de cletodim e haloxifope, em diferentes associações, no controle de capim-amargoso (Barroso et al., 2014; Gilo et al., 2016). Assim, não é possível determinar qual deste é mais eficaz para o controle de capim-amargoso em todas as situações, sendo a escolha deve ser embasada de uma série de fatores, entre eles o histórico de uso destes herbicidas na área. Como destacado por López-Ovejero et al. (2017) e Takano et al. (2018) ressalta-se a importância da rotação de mecanismos de ação na prevenção de biótipos de capim-amargoso resistentes a herbicidas e seu monitoramento.
Além dos herbicidas inibidores da ACCase, também pode-se destacar produtos de contato, como glufosinato, usados em plantas jovens e em sequenciais. Melo et al. (2012), Gemelli et al. (2013) verificaram a eficácia deste herbicida em pós-emergência de capim-amargoso, com possibilidade de uso na entressafra e dessecação pré-semeadura, ou ainda em pósemergência do milho e soja transgênicos tolerantes a este herbicida. Nesse sentido, cabe mencionar resultados promissores quanto as associações possíveis entre glufosinato e herbicidas inibidores da PROTOX, assim como associações entre inibidores da ACCase e inibidores da PROTOX, misturas essas com efeito sinérgico potencial no controle de capim-amargoso. Essas associações sinérgicas, além de melhorar a performance em folhas estreitas, amplia espectro sobre folhas largas. Tal sinergismo potencial contrasta com possíveis antagonismos nas associações entre inibidores da ACCase e herbicidas auxínicos, ou mesmo alguns inibidores da ACCase e inibidores da ALS, portanto as misturas são ponto de estrita atenção para os recomendantes (Pereira et al., 2018; Gomes et al., 2020).
Também o uso de herbicidas pré-emergentes, por exemplo smetolacloro, flumioxazina, imazetapir, sulfentrazona, clomazona, diclosulam, entre outros, é muito importante no manejo do capim-amargoso (Drehmer et al., 2015), com controle eficaz em sistemas de manejo com culturas de cobertura (Marochi et al., 2018). Não pormenorizando outros típicos graminicidas inibidores do crescimento inicial, amplamente utilizados no passado, como pendimetalina e trifluralina e, destacando associações comerciais, como flumioxazina + imazetapir, sulfentrazona + diurom, entre outras possíveis. Observando que as aplicações na proximidade da semeadura da soja, são efetivas em conferir uma dianteira competitiva a cultura, aumentando o PAI (período anterior a interferência) e diminuindo por consequência o PCPI (período crítico de prevenção e interferência), além de permitir uma desejável rotação de mecanismo de ação (mais favorável com o uso dos pré-emergentes).
A associação do controle químico, com a roçada, também se mostra eficaz no controle de capim-amargoso, sendo alternativa sobretudo para plantas perenizadas (Correia et al., 2015; Raimondi et al., 2019). O que pode proporcionar o esgotamento de reservas do rizoma e propiciar após a rebrota um controle mais eficaz da touceira. Nesse sentido, todas as estratégias possíveis de controle devem ser usadas e associadas em termos de sistema produtivo. Nesse sentido, até mesmo a capina manual de touceiras remanescentes pode ser uma opção interessante.
Portanto, dentro de um contexto do manejo integrado de plantas daninhas, o manejo de resistência do capim-amargoso deve envolver um conjunto de práticas a ser implementadas no sistema produtivo, sendo o controle químico parte integrante. O manejo de herbicidas deve ser feito levando em conta todas as boas práticas agrícolas, que incluam as exigências na tecnologia de aplicação e rotação de mecanismos de ação. O controle com pré-emergentes é uma necessidade, e no controle em pósemergência, as plantas mais jovens, até três perfilhos, são preferências, para o efetivo controle por existir mais opções de herbicidas. No entanto, plantas rizomatosas, entouceiradas e perenizadas, exigem de duas a três intervenções pelo menos, que envolvem o uso de herbicidas graminicidas sistêmicos, e alternativamente herbicidas de contato em sequencial. Tudo objetivando a mínima interferência, a preservação de tecnologias e a sustentabilidade do agronegócio.
Autores:
- Leandro Paiola Albrecht – Universidade Federal do Paraná
- Alfredo Junior Paiola Albrecht – Universidade Federal do Paraná
- André Felipe Moreira Silva – Crop Science Pesquisa e Consultoria Agronômica
Referências
BARROSO, A. A. M., ALBRECHT, A. J. P., REIS, F. C., & VICTORIA FILHO R. (2014). ACCase and glyphosate different formulations herbicides association interactions on sourgrass control. Planta Daninha, 32(3): 619-627. https://doi.org/10.1590/S0100-83582014000300018
CANEDO, I. F., ARAÚJO, L. S., SILVA, L. G. B., VALENTE, M. D. S., FREITAS, M. A. M., CUNHA, P. C. R. (2019). Differential susceptibility to glyphosate herbicide and re-growth capacity of different populations of sourgrass. Revista Ceres, 66(1), 18-25. http://dx.doi.org/10.1590/0034-737x201966010003p
CASSOL, M., MATTIUZZI, M. D., ALBRECHT, A. J. P., ALBRECHT, L. P., BACCIN, L. C., SOUZA, C. N. Z. (2019). Efficiency of isolated and associated herbicides to control glyphosate resistant sourgrass. Planta Daninha, 37, e019190671. https://doi.org/10.1590/s0100-83582019370100060
CORREIA, N. M., ACRA, L. T., & BALIEIRO, G. (2015). Chemical control of different Digitaria insularis populations and management of a glyphosateresistant population. Planta Daninha, 33(1), 93-101. http://dx.doi.org/10.1590/S0100-83582015000100011
DREHMER, M. H., ZAGONEL, J., FERREIRA, C., & SENGER, M. (2015). Eficiência de herbicidas aplicados em pré-emergência para o controle de Digitaria insularis na cultura do feijão. Revista Brasileira de Herbicidas, 14(2), 141-147. http://dx.doi.org/10.7824/rbh.v14i2.395
GEMELLI, A., OLIVEIRA JÚNIOR, R. S., CONSTANTIN, J., BRAZ, G. B. P., JUMES, T. M. C., GHENO, E. A., RIOS, F. A., FRANCHINI, L. H. M. (2013). Estratégias para o controle de capim-amargoso (Digitaria insularis) resistente ao glyphosate na cultura milho safrinha. Revista Brasileira de Herbicidas, 12(2), 162-170. https://doi.org/10.7824/rbh.v12i2.201.
GILO, E. G., MENDONÇA, C. G., ESPÍRITO SANTO, T. L., & TEODORO, P. E. (2016). Alternatives for chemical management of sourgrass. Bioscience Journal, 32(4), 881-889. https://doi.org/10.14393/BJ-v32n4a2016-32786
GOMES, H. L. L., SAMBATTI, V. C., & DALAZEN, G. (2020). Sourgrass control in response to the association of 2,4-D to ACCase inhibitor herbicides. Bioscience Journal, 36(4), 1126-1136. https://doi.org/10.14393/BJv36n4a2020-47895
HEAP, I. (2020). The international herbicide-resistant weed database. Disponível em: www.weedscience.org. Acessado em: 07 de out. 2020.
LÓPEZ-OVEJERO, R. F., TAKANO, H. K., NICOLAI, M., FERREIRA, A., MELO, M. S. C., CAVENAGHI, A. L., CHRISTOFFOLETI, P. J., OLIVEIRA JÚNIOR, R. S. (2017) Frequency and dispersal of glyphosate-resistant sourgrass (Digitaria insularis) populations across Brazilian agricultural production areas. Weed Science, 65(2), 285-294. https://doi.org/10.1017/wsc.2016.31
MAROCHI, A., FERREIRA, A., TAKANO, H. K., OLIVEIRA JÚNIOR, R. S., LOPEZ-OVEJERO, R. F. (2018). Managing glyphosate-resistant weeds with cover crop associated with herbicide rotation and mixture. Ciência e Agrotecnologia, 42(4), 381-394. https://doi.org/10.1590/1413-70542018424017918
MELO, M. S. C., ROSA, L. E., BRUNHARO, C. A. C. G., NICOLAI, M., & CHRISTOFFOLETI, P. J. (2012). Alternativas para o controle químico de capim-amargoso (Digitaria insularis) resistente ao glyphosate. Revista Brasileira de Herbicidas, 11(2), 195-203. https://doi.org/10.7824/rbh.v11i2.145
MENDES, R. R., TAKANO, H. K., BIFFE, D. F., CONSTANTIN, J., & OLIVEIRA JUNIOR, R. S. (2020). Interval between sequential herbicide treatments for sourgrass management. Revista Caatinga, 33(3), 579-590. https://doi.org/10.1590/1983-21252020v33n301rc
OLIVEIRA JÚNIOR, R. S., CONSTANTIN, J., COSTA, J. M., CAVALIERI, S. D., ARANTES, J. G. Z., ALONSO, D. G., ROSO, A. C., BIFFE, D. F. (2006). Interaction between burndown systems and post-emergence weed control affecting soybean development and yield. Planta Daninha, 24(4), 721-732. http://dx.doi.org/10.1590/s0100-83582006000400013.
PEREIRA, G. R., ZOBIOLE, L. H. S., & ROSSI, C. V. S. (2018). Resposta no controle de capim-amargoso a mistura de tanque de glyphosate e haloxifope com auxinas sintéticas. Revista Brasileira de Herbicidas, 17(2), e606. https://doi.org/10.7824/rbh.v17i2.606
RAIMONDI, R. T., CONSTANTIN, J., OLIVEIRA JÚNIOR, R. S., & MENDES, R. R. (2019). Altura de roçada afeta o controle de capim-amargoso perenizado. Cultura Agronômica, 28(3), 254-267. http://dx.doi.org/10.32929/2446-8355.2019v28n3p254-267
TAKANO H. K., MELO M. S., LOPEZ-OVEJERO R. F., WESTRA P. H., GAINES T. A., DAYAN F. E. (2020). Trp2027Cys mutation evolves in Digitaria insularis with cross-resistance to ACCase inhibitors. Pesticide Biochemistry and Physiology, 164: 1 6. doi: 10.1016/j.pestbp.2019.12.011
TAKANO, H. K., OLIVEIRA JÚNIOR, R. S., CONSTANTIN, J., MANGOLIM, C. A., MACHADO, M. F. P. S., BEVILAQUA, M. R. R. (2018). Spread of glyphosate-resistant sourgrass (Digitaria insularis): Independent selections or merely propagule dissemination?. Weed Biology and Management, 18 (1), 50-59. https://doi.org/10.1111/wbm.12143
VELDMAN, J. W., & PUTZ, F. E. (2011). Grass-dominated vegetation, not species-diverse natural savanna, replaces degraded tropical forests on the southern edge of the Amazon Basin. Biological Conservation, 144(5), 1419-1429. https://doi.org/10.1016/j.biocon.2011.01.011
ZOBIOLE, L. H. S., KRENCHINSKI, F. H., ALBRECHT, A. J. P., PEREIRA, G., LUCIO, F. R., ROSSI, C., & RUBIN, R. S. (2016). Controle de capimamargoso perenizado em pleno florescimento. Revista Brasileira de Herbicidas, 15(2), 157-164. https://doi.org/10.7824/rbh.v15i2.47